Réinitialiser la polarité cellulaire sous l’effet de la lumière
Une perte de la polarité cellulaire, associée au processus métastatique, est fréquemment observée dans les tumeurs avancées. Comment un nouveau site de polarité est-il établi dans une cellule déjà asymétrique, processus critique dans un environnement dynamique ? Par une approche d’optogénétique, dans laquelle la lumière est utilisée pour contrôler finement la distribution de la GTPase Cdc42 ces travaux révèlent qu’un recrutement transitoire à l’ensemble de la membrane plasmique de la protéine Cdc42 constitutivement activée a pour résultat la formation de novo d’un cluster de vésicules de sécrétion, hautement dynamique, en absence de croissance directionnelle. Ces travaux sont publiés dans la revue Cell Reports.
Toutes les cellules ont une forme définie, étroitement adaptée à leur environnement et à leur fonction. Par exemple, les neurones, qui transmettent des messages du cerveau à la moelle épinière, ont une forme allongée, alors que les globules rouges, petits disques plats, peuvent facilement circuler à travers des capillaires étroits. Afin de générer des cellules de formes diverses, différents composants cellulaires, y compris le cytosquelette et les organites, doivent être répartis de manière asymétrique. Cette distribution asymétrique des composants cellulaires est appelée polarité cellulaire. De nombreux types cellulaires se polarisent en réponse à des signaux environnementaux. Des études sur plusieurs organismes ont mis en lumière les cassures de symétrie, qui expliquent comment une cellule symétrique devient asymétrique. Cependant, peu de choses sont connues sur les processus mis en œuvre dans une cellule déjà asymétrique pour établir un nouvel axe de polarité, processus déterminants dans un environnement en constante évolution.
Pour répondre à cette question les chercheurs étudient depuis plusieurs années la morphogenèse du champignon pathogène opportuniste de l’homme Candida albicans. Ce champignon, qui se développe par bourgeonnement comme la levure de boulanger Saccharomyces cerevisiae, répond également à une variété de signaux extracellulaires, en changeant sa polarité cellulaire de façon impressionnante et en formant des chaînes de cellules filamenteuses hautement polarisées qui adhèrent et envahissent les tissus de l'hôte.
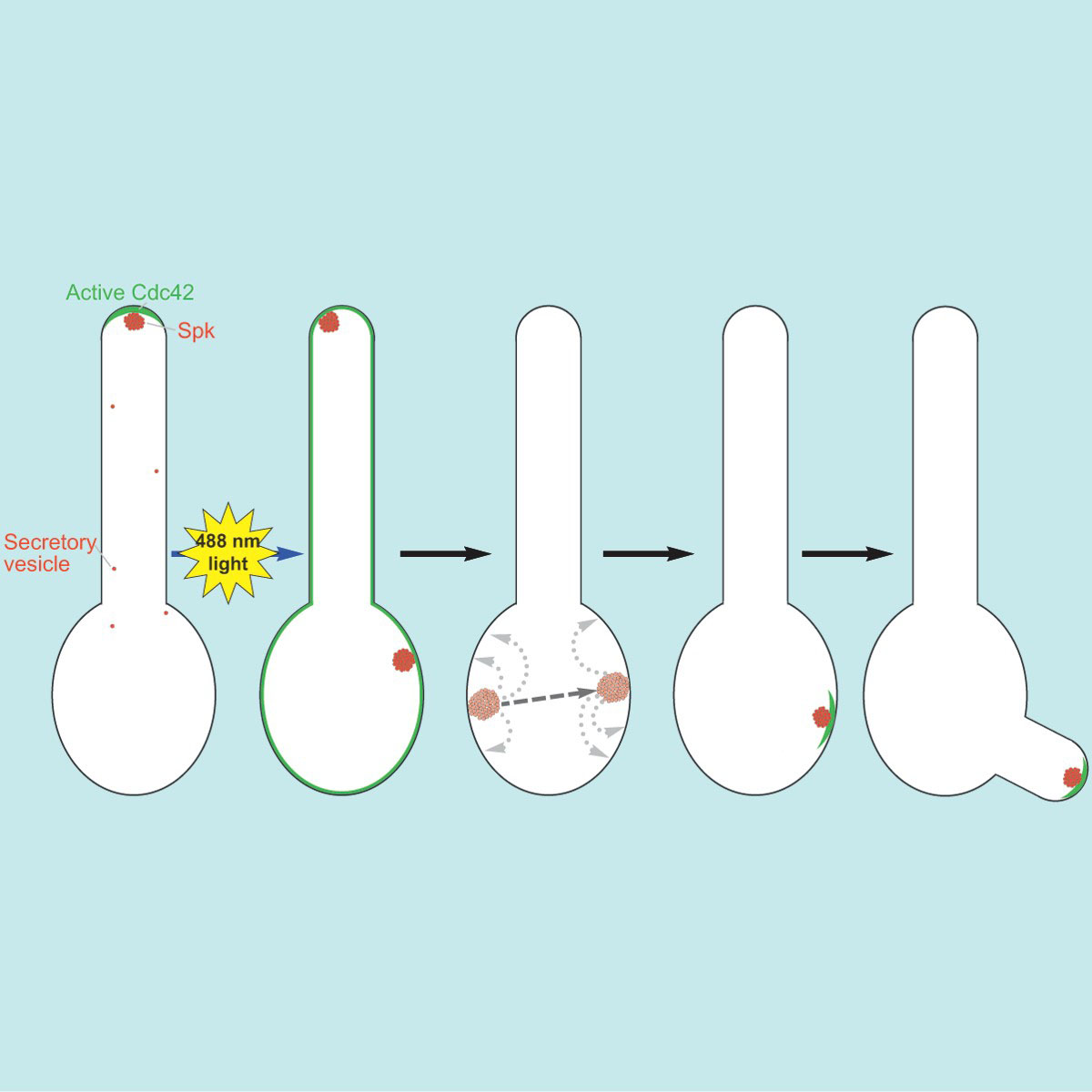
Les chercheurs ont tiré parti de protéines végétales, sensibles à la lumière, pour contrôler la distribution d'une protéine essentielle à la polarisation, la GTPase Cdc42, tres conservée au cours de l’évolution. Ils ont démontré que le recrutement d'une forme activée de Cdc42 à l’ensemble de la membrane plasmique, en utilisant la lumière, était suffisant pour réinitialiser la polarité dans une cellule asymétrique allongée. En effet, dans cette cellule hautement polarisée, qui avait initialement un avant et un arrière, la distribution asymétrique de ses composants cellulaires est maintenant abolie et la réinitialisation de la polarité dans de telles cellules perturbe le trafic de nouveau matériel moléculaire vers le site de croissance.
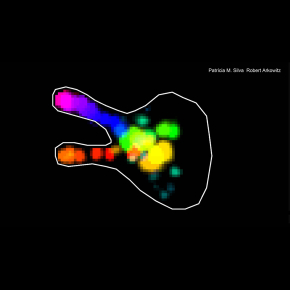
La délivrance de nouveau matériel, y compris d’une variété d'enzymes nécessaires à la croissance cellulaire, s'effectue par la voie de la sécrétion. Bien que le trafic membranaire soit perturbé, un cluster de vésicules de sécrétion se forme néanmoins lors du recrutement à la membrane plasmique de cette protéine Cdc42 activée. Ce cluster est très dynamique, se déplaçant par bonds le long du cortex cellulaire jusqu'à se stabiliser à un site d’où une nouvelle croissance émerge. Les chercheurs ont utilisé la microscopie sur cellules vivantes pour suivre la dynamique de ce cluster, ainsi que la modélisation mathématique afin de démontrer que le mouvement n'était pas aléatoire. Par conséquent, même en l'absence de croissance directionnelle, un cluster de vésicules peut se former, indiquant que cette accumulation de vésicules, normalement observée à l'extrémité de la cellule (appelée Spitzenkörper), n'est pas une conséquence de la croissance.
© Robert Arkowitz
Pour en savoir plus :
Secretory vesicle clustering in fungal filamentous cells does not require directional growth
M. Silva PM, PuernerC, SeminaraA, Bassilana M, A. ArkowitzRA
Cell Reports. 2019 August 20. doi. 10.1016/j.celrep.2019.07.062