Régulation ciblée d’une voie de signalisation cellulaire
La signalisation NF-kB assure des fonctions cellulaires essentielles. Sa dérégulation est source de pathologie grave. Cette voie de signalisation est régulée par la kinase IKK. Mais cette dernière est également impliquée dans d’autres processus cellulaires. Dans un article de la revue Nature Communications, des scientifiques décrivent les mécanismes expliquant la spécificité de la kinase vis-à-vis des substrats de la voie NF-κB. Ce mécanisme représente une cible thérapeutique prometteuse pour un large spectre de pathologies, allant du cancer aux maladies auto-immunes.
NF-kB, un régulateur essentiel du fonctionnement des cellules eucaryotes
La protéine NF-kB est un facteur de transcription, c’est-à-dire qu’elle est capable de se lier à l’ADN et ainsi de modifier l’expression du génome de la cellule. Elle est activée par un large spectre de stimuli et de récepteurs, selon le contexte cellulaire. Malgré la diversité de ces stimuli, il existe deux voies moléculaires (ou voies de signalisation) principales, la voie canonique et la voie alternative, qui convergent au niveau de la kinase IKK (inhibitor of kB Kinase).
Identifiée et caractérisée biochimiquement dans les années 90, IKK est progressivement apparue comme le point de contrôle clé de la signalisation NF-kB. Dans les cellules, IKK existe sous forme de différents complexes multiprotéiques, avec un noyau catalytique conservé constitué de dimères des sous-unités homologues IKKa et IKKb.
La signalisation NF-kB est altérée dans un large spectre de maladies humaines, ce qui fait d’IKK une cible thérapeutique majeure. Cependant, en plus des substrats liés aux voies NF-kB, IKK interagit également avec de nombreuses protéines partenaires au niveau d'autres voies de signalisation. Toutes les molécules ciblant l'IKK développées jusqu'à présent inhibent l'activité enzymatique, agissant ainsi sur toutes les fonctions cellulaires d’IKK, qu’elles soient NF-kB dépendantes ou non. Cela se traduit en un manque de spécificité et une haute toxicité de ces inhibiteurs.
Comprendre comment IKK peut contrôler spécifiquement NF-kB
Dans un article publié dans la revue Nature communications, les scientifiques ont réussi à montrer le mécanisme moléculaire qui permettait de comprendre comment IKK pouvait réagir de manière spécifique à la voie NF-κB.
Par une approche basée sur des expériences in vitro et in cellulo, les auteurs ont identifié un nouveau petit motif linéaire (ou SLiM pour ‘Small Linear Motif), qui est conservé dans les substrats des voies canoniques et alternatives d’NF-kB uniquement, et qui assure ‘l’amarrage’ (ou ‘docking’) aux dimères catalytiques d’IKK. Cette interaction protéine-protéine favorise ensuite la phosphorylation efficace du substrat, qui a lieu dans une séquence conservée distincte du motif identifié dans cette étude. Les scientifiques ont également réalisé des analyses de biologie structurale intégrée dont les résultats montrent que le motif se lie à un sillon à l'interface du dimère catalytique. De manière intéressante, la phosphorylation physiologique du motif supprime l'interaction avec IKK et ceci est corrélé à une diminution de l'expression des gènes cibles d’NF-κB.
Fort de ces résultats, ils ont donc exploité les connaissances sur le mécanisme de ‘docking’ pour concevoir un ligand bivalent dérivé du motif d'amarrage. Ce ligand, qui se lie spécifiquement au sillon d'IKK, inhibe la phosphorylation du substrat et les événements moléculaires en aval au niveau de la voie canonique NF-kB.
En conclusion, les résultats dérivés de cette étude montrent que par un noyau catalytique et un motif linéaire conservés, IKK est capable d’interagir avec plusieurs partenaires dans les voies de signalisation NF-kB. Ceci ouvre à son tour la voie à la conception de modulateurs spécifiques de la signalisation NF-kB basé sur une approche d’inhibition des interactions protéine-protéine.
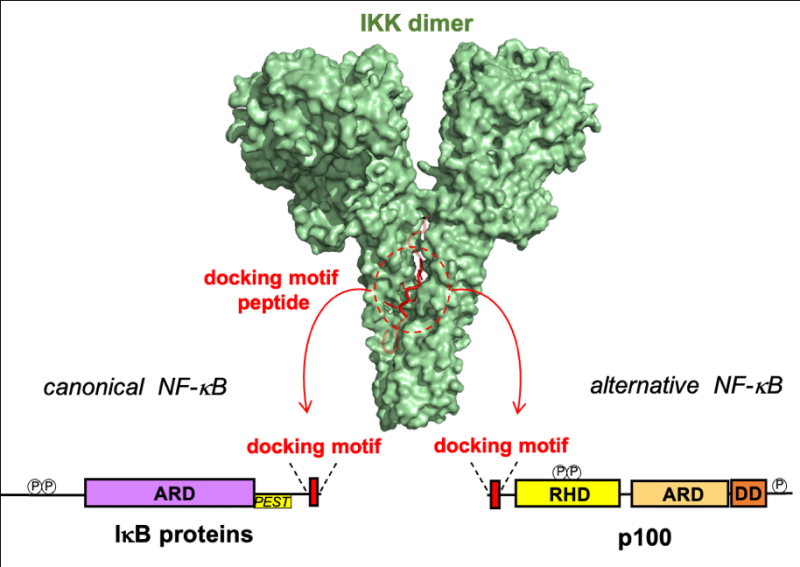
Figure : Model 3D de l’interaction entre le dimère catalytique d’IKK (vert) et le motif de ‘docking’ (rouge). Les flèches indiquent la localisation du motif au niveau de l’architecture des protéines substrats.
Pour en savoir plus : Molecular mechanism of IKK catalytic dimer docking to NF-kB substrates, Li C., Moro S., Shostak S., O’Reilly F., Graziadei A., Donzeau M., Mc-Ewen A., Desplancq D., Poussin-Courmontagne P., Bachelart T., Martinez-Zapien D., Fiskin M., Straub M.L., Berrodier N., Pichard S., Brillet K., Orfanoudakis G., Tommasino M., Poterszman A., Torbeev V., Rappsilber J., Davey N., Chariot A. and Zanier K.
Nature Communications, 3 septembre 2024, DOI : 10.1038/s41467-024-52076-0
Contact
Laboratoire
Biotechnologie et signalisation cellulaire - BSC (CNRS/Université de Strasbourg)
300 boulevard Sébastien Brant
67412 Illkirch-Graffenstaden
