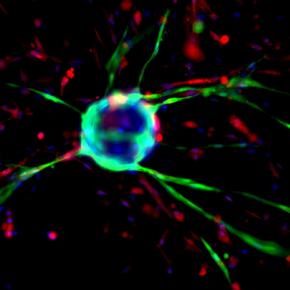
Régénération musculaire : le couplage entre myogenèse et angiogenèse est stimulé par les macrophages
Après une lésion, le muscle squelettique régénère grâce aux cellules souches qui enclenchent la myogenèse et dans le même temps, le lit vasculaire se reforme par angiogenèse. L'équipe de Bénédicte Chazaud à l’Institut NeuroMyoGène, montre que myogenèse et angiogenèse sont deux processus couplés aux plans cellulaire et moléculaire et stimulés par les macrophages réparateurs. Cette étude qui illustre la complexité des interactions cellulaires permettant la régénération musculaire, a été publiée le 30 novembre 2017 dans la revue Stem Cell Reports.
Après une blessure, le muscle strié squelettique est capable de régénérer ad integrum et de recouvrir complètement sa fonction. Ceci est possible grâce aux cellules souches myogéniques qui s'activent en cas de lésion et suivent le programme de myogenèse adulte pour reformer de nouvelles fibres fonctionnelles après des étapes d'expansion, puis de différenciation. Dans le même temps, le lit vasculaire endommagé se reforme par le processus d'angiogenèse à partir des cellules endothéliales existantes. Ainsi, au niveau tissulaire, les deux processus ont lieu de manière concomitante. L'objectif de cette étude était de mettre en évidence un couplage entre myogenèse et angiogenèse au niveau cellulaire et d'en étudier la régulation au niveau moléculaire.
A l'aide de différents systèmes de co-culture de cellules endothéliales et de cellules précurseurs myogéniques humaines, notamment une co-culture en 3 dimensions, les chercheurs montrent que les cellules endothéliales ont une activité pro-myogénique et que les cellules myogéniques ont une activité pro-angiogénique, cette dernière étant augmentée au fur et à mesure de la différenciation myogénique des précurseurs musculaires. Ces résultats sont confirmés in vivo, établissant le couplage cellulaire entre myogenèse et angiogenèse.
Une analyse transcriptomique a été réalisée à partir des cellules souches myogéniques et des cellules endothéliales isolées du muscle à différents temps au cours de la régénération. L'analyse des effecteurs secrétés par les deux types cellulaires a permis d'en identifier trois qui n’avaient jamais été impliqués dans la régénération musculaire jusqu'à présent : l'oncostatine M, la périostine et l'apeline. Des expériences fonctionnelles "gain de fonction" in vitro ont montré un effet positif des trois effecteurs sur la myogenèse et l'angiogenèse. Des expériences "perte de fonction" dans le système 3 dimensions in vitro ont démontré le couplage moléculaire entre myogenèse et angiogenèse. En outre, l'inhibition de ces trois effecteurs in vivo par injection d'anticorps bloquants au cours de la régénération musculaire altère l'ensemble des paramètres attestant d'une myogenèse normale, ainsi que la vascularisation des nouvelles fibres. La sécrétion de l'apeline, de l'oncostatine M et de la périostine est donc nécessaire pour une bonne régénération musculaire.
Enfin, l'analyse de l'expression des trois effecteurs par l'ensemble des cellules présentes dans le muscle en régénération a montré que les macrophages réparateurs, qui sont présents lors de la phase de reconstruction du muscle, expriment fortement l'oncostatine M. Des expériences de tri-culture en 3D utilisant des anticorps bloquants ont montré que les macrophages réparateurs stimulent le couplage angiogenèse/myogenèse par la sécrétion d'oncostatine M.
L'ensemble de cette étude montre que la myogenèse et l'angiogenèse sont des processus biologiques couplés et régulés par les mêmes effecteurs moléculaires au cours de la régénération musculaire. La régulation spatio-temporelle de la sécrétion de ces effecteurs dans le microenvironnement par les différentes cellules partenaires (précurseurs myogéniques, cellules endothéliales, macrophages) permet la coordination de ce couplage, assurant ainsi une régénération musculaire efficace.
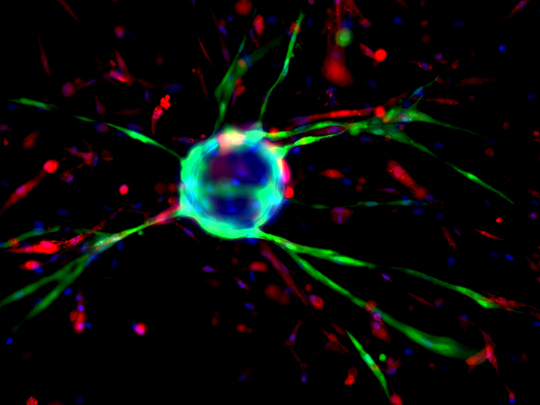
© Claire Latroche, Michèle Weiss-Gayet, Bénédicte Chazaud
En savoir plus
-
Coupling between myogenesis and angiogenesis during skeletal muscle regeneration is stimulated by restorative macrophages.
Claire Latroche Michèle Weiss-Gayet, Laurent Muller, Cyril Gitiaux, Pascal Leblanc, Sophie Liot, Sabrina Ben-Larbi, Rana Abou-Khalil, Nicolas Verger, Paul Bardot, Mélanie Magnan, Fabrice Chrétien, Rémi Mounier, Stéphane Germain, Bénédicte Chazaud Stem Cell Rep. Published Online: November 30, 2017.