Radiotolérance bactérienne : une régulation haute couture !
La structure 3D d’un régulateur clé pour la radiotolérance chez Deinococcus a été résolue. Ces travaux publiés dans Nucleic Acids Research décrivent un mécanisme moléculaire original de levée de répression qui conduit à la réparation de l’ADN en cas de stress environnemental sévère.
Les bactéries du genre Deinococcus sont des organismes extrêmement tolérants aux radiations ionisantes et à certains stress environnementaux. Elles supportent par exemple des doses de radiation de l’ordre de 5000 Gy (Gray) alors que 200 Gy est une dose létale pour la plupart des bactéries et qu’une exposition de 5 à 10 Gy seulement suffit pour tuer les cellules humaines! Les chercheurs ont élucidé la structure 3D du répresseur DdrO qui contrôle la réponse aux radiations et à d’autres agents qui endommagent l’ADN chez la bactérie radiotolérante Deinococcus deserti. Cette structure leur a permis de décrypter le mécanisme moléculaire qui orchestre la réparation de l’ADN quand la bactérie est soumise à un stress radiatif ou autre stress environnemental sévère tel que la dessiccation ou l’exposition aux rayons UV.
Le répresseur DdrO possède 2 domaines interdépendants : un domaine N-terminal, classique, qui interagit directement avec l’ADN, et un domaine C-terminal qui présente un nouveau repliement et qui est la cible de l’enzyme sentinelle IrrE. Le domaine C-terminal est nécessaire pour la formation de dimères de DdrO qui peuvent se fixer à l’ADN et ainsi réprimer les gènes cibles. IrrE est une métalloprotéase dont la fonction est de couper une liaison peptidique précise. En conditions standard, cette protéase est au repos. Quand la bactérie est soumise à un stress, l’enzyme est activée et coupe le répresseur qui ne peut plus se fixer à l’ADN. La cellule produit alors un pool de protéines qui va réparer les nombreux dommages de l’ADN. Le travail de couturières mis en œuvre conduit ainsi à la survie des cellules.
Chez les Deinococcus, le répresseur DdrO et la métalloprotéase IrrE forment un tandem performant de protéines. Le site de clivage de DdrO ne se dévoile que sous sa forme monomérique. Il est alors accessible à IrrE qui le coupe ce qui a pour effet de perturber l’équilibre dynamique entre les trois formes de DdrO présentes au cœur de la cellule : dimère lié à l’ADN, dimère libre, monomère libre. Plus IrrE coupe de monomères, plus l’équilibre se déplace vers le monomère, ce qui induit encore plus de découpes du répresseur. Quand il n'y a plus de DdrO, l'ADN libéré peut être transcrit et les protéines produites.
Les deux protagonistes IrrE et DdrO appartiennent respectivement à la famille des métalloenzymes COG2856 et des régulateurs XRE. Ces paires de protéines se retrouvent chez de nombreuses bactéries, environnementales, pathogènes ou utilisées dans l’industrie où elles sont actuellement peu caractérisées. Certains couples contrôlent la production de phages virulents qui tuent les bactéries, notamment Streptococcus thermophilus utilisée dans l’industrie laitière. Les chercheurs soupçonnent également ce type de couple d’être à l’origine de la genèse de toxines qui induiraient la dormance de bactéries pathogènes devenant de fait tolérantes aux antibiotiques. Connaître les clés du mécanisme moléculaire orchestré par IrrE et DdrO chez les Deinocoques ouvre la voie à des stratégies pour contrecarrer les effets néfastes dus à des paires de protéines similaires.
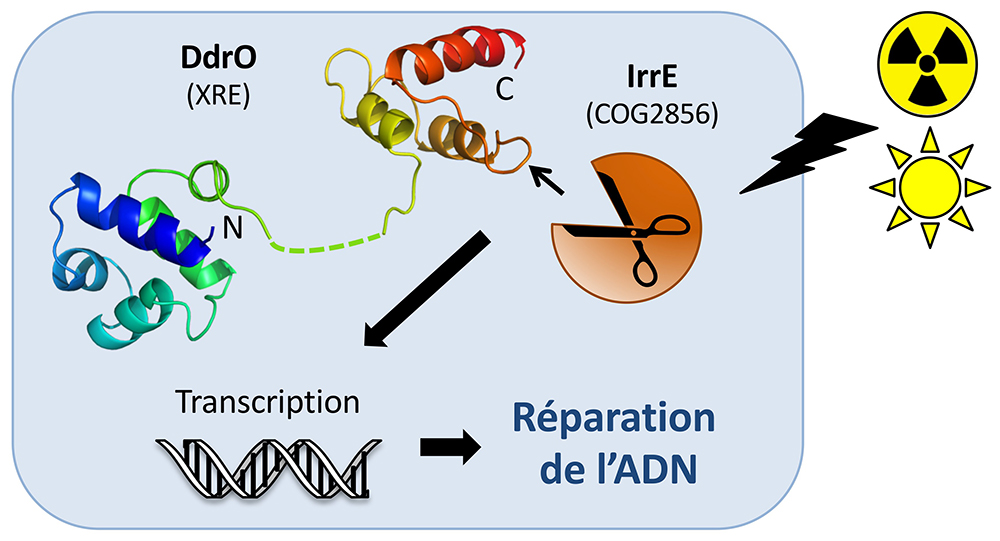
Figure : Après radiation ou autres stress génotoxiques, la métalloprotéase IrrE coupe le répresseur DdrO exactement entre les résidus 106 et 107. Le répresseur est alors inactivé ce qui permet la production de protéines nécessaires à la réparation de l’ADN endommagé.
Pour en savoir plus:
Crystal structure of the transcriptional repressor DdrO: insight into the metalloprotease/repressor-controlled radiation response in Deinococcus.
De Groot A, Siponen MI, Magerand R, Eugénie N, Martin-Arevalillo R, Doloy J, Lemaire D, Brandelet G, Parcy F, Dumas R, Roche P, Servant P, Confalonieri F, Arnoux P, Pignol D, Blanchard L.
Nucleic Acids Res. 2019 Dec 2;47(21):11403-11417. doi: 10.1093/nar/gkz883. PMID: 31598697