Qu'est-ce qui fait de la thiénoguanosine une sonde ADN fluorescente exceptionnelle?
La thiénoguanosine est un analogue hautement fluorescent de la guanosine, capable de substituer parfaitement et suivre sélectivement la conformation et la dynamique d'une guanosine donnée dans un ADN. Une publication parue dans la revue Journal of the American Chemical Society révèle les mécanismes photophysiques à l’origine de ses propriétés fluorescentes exceptionnelles dans l’ADN. Cette compréhension est critique pour exploiter tout le potentiel de ce nucléoside fluorescent et développer ses applications futures.
Les molécules d'ADN jouent un rôle clé en codant les informations génétiques nécessaires au vivant. Pour assurer ce rôle, elles doivent interagir avec un grand nombre de protéines qui peuvent modifier la structure, la conformation, ou la dynamique de la double hélice d'ADN. Ces effets peuvent être localisés, comme dans les événements de basculement de bases, ou affecter les molécules d'ADN dans leur ensemble, lorsqu'elles sont compactées par des histones ou déroulées par des hélicases ou des chaperons d'acide nucléique. Pour interroger les mécanismes moléculaires de ces interactions, les techniques de fluorescence sont un outil de choix en raison de leurs excellentes sensibilité et résolution spatio-temporelle. Cependant, comme les bases naturelles ne sont pratiquement pas fluorescentes, il est nécessaire de recourir à des analogues fluorescents de bases, capables de substituer sans perturbation les bases naturelles et émettre une fluorescence intense, sensible à l'environnement.
La thiénoguanosine (thG) récemment développée est un substitut isomorphe de la guanosine (G), qui apparaît particulièrement prometteuse à cet égard, remplaçant presque parfaitement les résidus G dans les ADN double brin appariés et non appariés. De plus, contrairement à de nombreux autres analogues fluorescents de bases, la thG n'est pas fortement éteinte lorsqu'elle est incorporée dans des séquences ADN et peut donc être utilisée pour suivre sélectivement la conformation et la dynamique d'un résidu G donné dans un ADN. Jusqu’à présent, la plupart des applications proposées pour cette sonde reposaient sur des changements empiriques de son intensité de fluorescence et n'exploitaient donc pas tout le potentiel de cette sonde riche en informations. La raison principale est que les propriétés photophysiques de la thG, en particulier lorsqu’elle est incluse dans l'ADN sont encore largement incomprises.
Pour exploiter tout le potentiel de cette base fluorescente, comprendre sa photophysique dans l'ADN et développer rationnellement ses applications futures, les chercheurs, dans le cadre d'une collaboration avec des laboratoires de Naples, San Diego et de Sienne, ont étudié vingt duplex d'ADN, où les bases opposées et voisines de thG étaient systématiquement variées. En utilisant la spectroscopie de fluorescence, des simulations de dynamique moléculaire et des calculs mixtes de mécanique quantique / mécanique moléculaire, ils montrent que, dans les duplex appariés, le rendement quantique et les temps de vie de fluorescence de thG apparaissent quasiment indépendants des bases voisines.
Ce résultat est attribué à l’appariement "Watson-Crick" de la thG avec la cytosine, qui maintient une orientation et une distance stables entre les nucléobases, de sorte qu'un mécanisme de transfert de charge (CT) unique régit la photophysique de thG indépendamment de ses bases voisines. De ce fait, thG peut donc remplacer n'importe quel résidu G dans des duplex appariés, tout en conservant des caractéristiques photophysiques inchangées. En revanche, la déstabilisation locale induite par un mésappariement ou un site abasique instaure une forte dépendance du contexte environnemental des rendements quantiques et temps de vie de fluorescence de la thG. Cette dépendance est régie par l'efficacité de formation du CT et l'exposition au solvant de la thG.
En raison de cette sensibilité, thG apparait idéale pour suivre des changements structurels locaux dans les interactions protéines/ADN et identifier un polymorphisme d’un seul nucléoside. De plus, le temps de vie de fluorescence dominant de la thG dans l’ADN est inhabituellement élevé (9 à 29 ns), ce qui facilite sa mesure sélective dans des milieux complexes en utilisant un schéma de détection basé sur les temps de vie ou des fenêtres temporelles. Ces résultats permettent de rationaliser pour la première fois les propriétés spectroscopiques de la thG dans les duplex d'ADN, en identifiant les différents effets modulant ses caractéristiques photophysiques. Cette analyse valide thG comme une base fluorescente unique combinant une substitution presque parfaite des résidus G, la préservation d'une fluorescence élevée, des durées de vie de fluorescence exceptionnellement longues et une forte sensibilité à l'exposition au solvant et au contexte de l'ADN. Cette étude ouvre de nouvelles possibilités pour l'utilisation rationnelle et l'interprétation des données de séquences marquées à la thG dans ses applications.
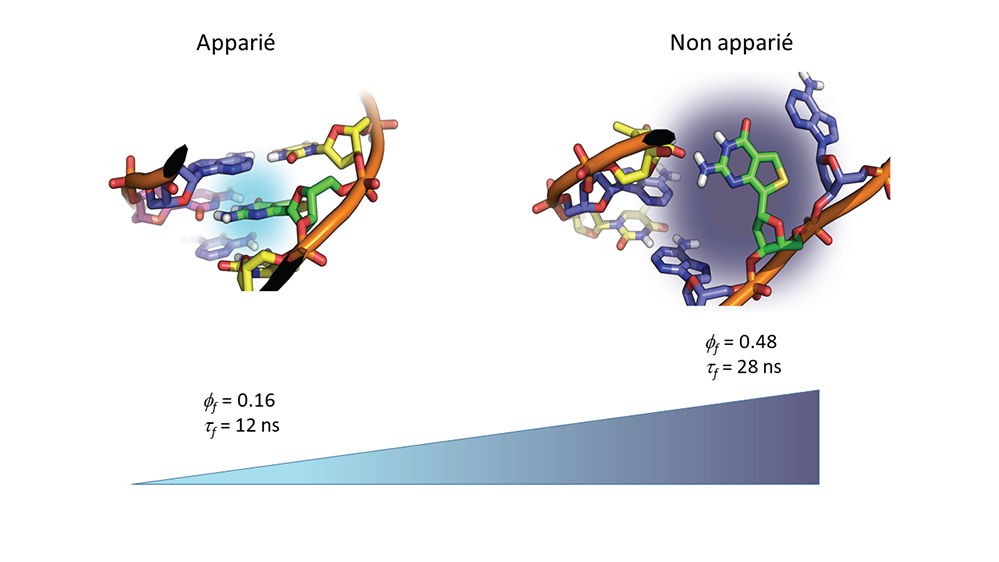
Figure : Modélisation moléculaire et propriétés de fluorescence de doubles brins d’ADN marqués à la thiénoguanosine. Dans un duplex où la thiénoguanosine (en vert) est appariée à une cytosine dans une géométrie Watson-Crick (figure de gauche), la stabilité de cet appariement permet un empilement avec les bases voisines. Cet empilement favorise un transfert de charge dont la direction mais non l’amplitude dépend de la nature de la base voisine. Ce transfert éteint en partie l’émission de la sonde, qui conserve néanmoins un rendement quantique et un temps de fluorescence élevés. Dans un double brin où la thiénoguanosine est appariée à une base non complémentaire comme l’adénosine par exemple (figure de droite), la déstabilisation de la séquence réduit l’efficacité du transfert de charge avec les bases voisines, conférant ainsi à la base fluorescente un rendement quantique et un temps de vie de fluorescence très élevés.
Pour en savoir plus :
What makes thienoguanosine an outstanding fluorescent DNA probe?
Kuchlyan J, Martinez-Fernandez L, Mori M, Gavvala K, Ciaco S, Boudier C, Richert L, Didier P, Tor Y, Improta R, Mély Y.
J Am Chem Soc. 2020 Sep 11. doi: 10.1021/jacs.0c06165.
Contact
Laboratoire
Laboratoire de Bioimagerie et Pathologies (CNRS, Université de Strasbourg)
Faculté de Pharmacie
74 route du Rhin
F - 67401 Illkirch