Que la force soit avec le réseau supracellulaire pour changer de forme !
Au cours du développement, les organes subissent des forces à grande échelle initiées à l’échelle du cytosquelette. Cependant, l’origine et la régulation moléculaire des réseaux cytosquelettiques supracellulaires restent peu connues. Dans cette étude, publiée dans la revue Nature Communications, les scientifiques démontrent qu’un réseau supracellulaire contrôlé par la petite GTPase Cdc42 établit des forces polarisées et conduit à l’extension de la chambre à œufs chez la drosophile.
La compréhension des mécanismes qui contrôlent la formation des organes et des tissus est un enjeu fondamental en biologie. Les réseaux d’actomyosine, formés par l’assemblage des protéines actine et myosine, jouent un rôle crucial dans cette morphogénèse. Leur architecture peut s’étendre au-delà de la taille d’une cellule unique: il en résulte des structures d’actomyosine supracellulaires à l’échelle d’un tissu ou de l’animal entier. Chez la mouche drosophile, l’œuf est obtenu à partir de la chambre à œufs dont la forme passe de sphérique à ovoïde au cours de sa croissance. Cette élongation est induite par l’oscillation de la myosine au niveau basal des cellules folliculaires. Cependant, bien que certains processus moléculaires du contrôle de l’élongation soient connus à l’échelle subcellulaire, l’origine du cytosquelette à l’échelle supracellulaire, ses propriétés émergentes, ainsi que les forces mécaniques engendrées par celui-ci, restent méconnues.
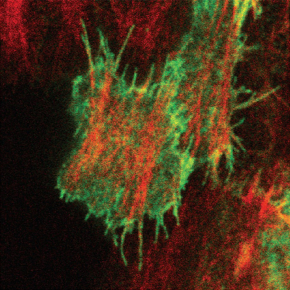
En prenant comme modèle d’étude l’ovaire de drosophile, les chercheurs ont exploré l’origine et la fonction des réseaux supracellulaires d’actomyosine grâce à des techniques de pointe d’optogénétique et de manipulation laser. Avec cette étude, ils démontrent qu’un réseau supracellulaire et polarisé de fibres d’actine, qui enveloppe le follicule ovarien, émerge à partir de filopodes. Ceux-ci rayonnent de manière polarisée depuis des fibres de stress basales et s’étendent en pénétrant les cortex cellulaires voisins (figure a). Les filopodes peuvent être mécanosensibles et fonctionner comme des points d’ancrage entre cellules. La petite GTPase Cdc42 régit la formation et la distribution des filopodes intercellulaires et des fibres de stress dans les cellules folliculaires. Ainsi, un réseau cytosquelettique supracellulaire, contrôlé par Cdc42, constitue un échafaudage intégrant à l’échelle tissulaire des contractions d’actomyosine oscillantes locales aux cellules, engendrant des forces de contraction polarisées et l’élongation subséquente du tissu folliculaire (figure b, c).
Ces résultats ont pu être obtenus en combinant la génétique de la drosophile, l’imagerie des tissus vivants, l’optogénétique et l’ablation laser. Grace à la création d'un nouvel outil optogénétique nommé « photoactivable-Cdc42 » (PA-Cdc42 sur la figure d), les chercheurs ont pu déterminer localement et rapidement la fonction de Cdc42 dans les cellules folliculaires, révélant ainsi des aspects inconnus, impossibles à caractériser par des outils génétiques classiques. Les scientifiques ont également utilisé l’ablation laser femtoseconde infrarouge pour disséquer les forces subcellulaires des forces supracellulaires, démontrant ainsi le rôle de ce réseau supracellulaire.
Ce travail montre pour la première fois comment un réseau supracellulaire est formé dans le domaine basal des cellules pour générer les forces nécessaires pour changer la forme d’un tissu épithélial.
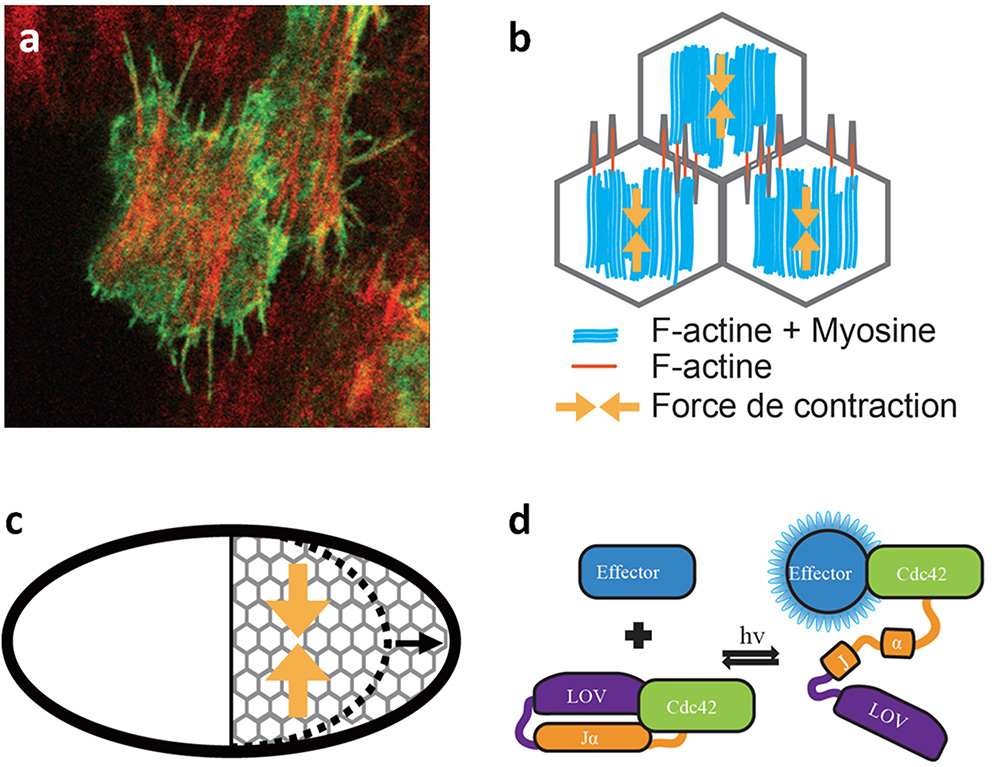
Figure : a. Vue basale des cellules clones co-exprimant mCD8GFP (en vert) et moeABD-mCherry (en rouge), montrant que les filopodes rayonnent à partir du réseau de fibres de stress médial-basal. b-c. Représentation schématique des cellules folliculaires et de la distribution subcellulaire des fibres de stress et des filopodes intercellulaires formant un réseau contractile supracellulaire (b) entourant la chambre d'oeuf et générant des forces à l'échelle du tissu ce qui entraîne l'élongation du tissu selon l’axe antéro-postérieur (c). d. Diagramme schématique montrant le mécanisme de photoactivation du PA-Cdc42 par la lumière bleue (hv).
Pour en savoir plus
A Cdc42-mediated supracellular network drives polarized forces and Drosophila egg chamber extension.
Popkova A, Stone OJ, Chen L, Qin X, Liu C, Liu J, Belguise K, Montell DJ, Hahn KM, Rauzi M, Wang X.
Nat Commun. 2020 Apr 21;11(1):1921. doi: 10.1038/s41467-020-15593-2.
Contact
Laboratoires
LBCMCP-CBI (Laboratoire de Biologie Cellulaire et Moléculaire du Contrôle de la Prolifération - Centre de Biologie Intégrative) - (CNRS/Université Paul Sabatier)
118 Route de Narbonne, 31062 Toulouse Cedex
Institut de Biologie Valrose (iBV) - (CNRS/Université Côte d’Azur)
Parc Valrose 06108 Nice cedex