Quand les Pili s’activent aux pôles des bactéries motiles
La capacité de se mouvoir en groupe est un trait essentiel du monde bactérien pour coloniser de nouvelles niches écologiques, dans l’environnement et chez l’hôte pour les agents pathogènes. Dans un article paru dans le journal PNAS, les scientifiques ont caractérisé le mécanisme moléculaire qui permet l’activation des pili de Type-IV chez la bactérie sociale Myxococcus xanthus. Ces travaux révèlent le contrôle de ce processus par des petites protéines G qui recrutent directement un nouvel activateur au pôle des cellules.
Les Bactéries possèdent des appendices extracellulaires dynamiques appelés Pili de Type IV, qui polymérisent des fibres extracellulaires rétractiles permettant de multiples fonctions cellulaires distinctes comme l’adhésion aux cellules, l’import d’ADN extracellulaire (mécanisme dénommé "compétence") ou encore la motilité sur des surfaces en tractant les cellules par un assemblage au pôle avant. Dans le cadre de cette dernière fonction, le mécanisme d’activation de ces pili reste peu compris.
Les scientifiques ont démontré que les pili sont activés par l’action spatiale d’une petite GTPase de la superfamille Ras, MglA (les GTPases sont des protéines impliquées dans de nombreuses régulations via leur activité d'hydrolyse de la guanosine triphosphate -GTP- ) . En visualisant directement les pili en action grâce à la microscopie de fluorescence par réflexion totale interne (TIRF), ils ont pu montrer que lorsque MglA est sous sa forme active associée au GTP, elle interagit avec une protéine SgmX, démasquant un site d’interaction de cette protéine avec le pilus. Cette interaction permet alors d’adresser SgmX au pôle de la cellule ou elle active les pili. En outre, le contrôle dynamique de SgmX par MglA permet de changer de pôle actif en fonction de signaux externes et ainsi aux bactéries de changer leur direction de mouvement.
Ces travaux ouvrent des perspectives pour comprendre comment des pili sont activés au pôle de bactéries motiles et révèlent que, chez les bactéries, les petites protéines G fonctionnent également comme des interrupteurs moléculaires pour l’activation spatiale de fonctions cellulaires. Etudier le mode d’action de SgmX, une protéine modulaires comportant des répétitions de domaines TPR (répetitions d'un motif protéique de 34 acides aminés), sera déterminant pour comprendre comment les pili sont activés et comment leur activité permet à des centaines de cellules de synchroniser leur mouvement.
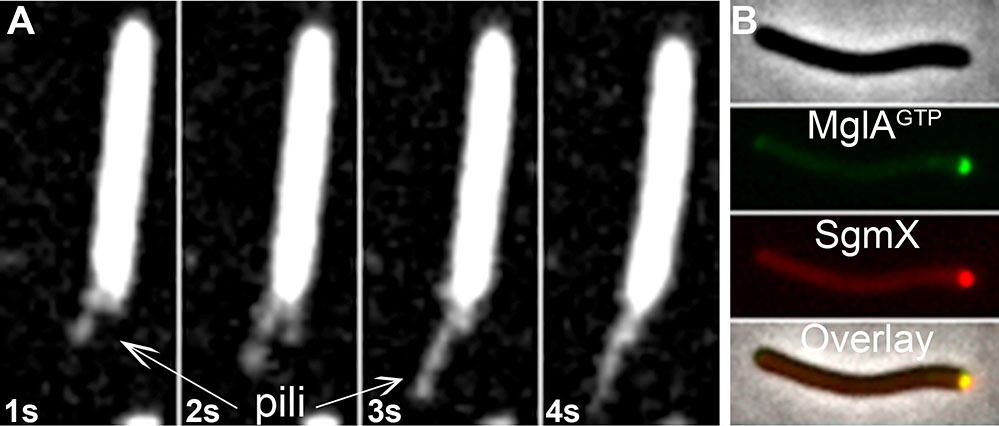
Figure :
A_ Visualisation des Pili en action grâce à la microscopie de fluorescence par réflexion totale interne (TIRF).
B_ Localisation intracellulaire des protéines MglA (Vert) et SgmX (Rouge)
Pour en savoir plus :
The polar Ras-like GTPase MglA activates type IV pilus via SgmX to enable twitching motility in Myxococcus xanthus.
Mercier R, Bautista S, Delannoy M, Gibert M, Guiseppi A, Herrou J, Mauriello EMF, Mignot T.
Proc Natl Acad Sci U S A. 2020 Oct 22:202002783. doi: 10.1073/pnas.2002783117.
Contact
Laboratoire
Laboratoire de Chimie Bactérienne - (CNRS/Aix-Marseille Université)
31 Chemin Joseph Aiguier, 13009 Marseille, France
