Quand des fibrilles « furtives » d’alpha-synucléine prennent le dessus
L’alpha-synucléine est une petite protéine impliquée dans la régulation de la neurotransmission neuronale. Cette étude, parue dans la revue Science Advances, démontre que l'émergence spontanée stochastique de polymorphes amyloides « furtifs » peut avoir lieu pendant la préparation standard de fibrilles d’alpha-synucléine. Ces polymorphes, qui échappent à l’outil de détection de routine que représente la Thioflavine T, étaient jusqu’alors passés inaperçus. Ils peuvent pourtant proliférer dans la population fibrillaire et être à l’origine d’une synucléinopathie intracérébrale particulièrement invasive.
L’alpha-synucléine est associée à plusieurs maladies neurodégénératives, comme la maladie de Parkinson (MP), la démence à corps de Lewy et l’atrophie multisystématisée (MSA). L’alpha-synucléine est une protéine particulièrement flexible dont la conformation oscille entre différentes formes. En condition pathologique, l’alpha-synucléine cesse d’osciller entre différentes conformations et reste « figée» dans une conformation particulière à l’origine de son empilement et de la formation d’agrégats amyloïdes fibrillaires. Il est maintenant admis que ce processus est auto-entretenu et similaire à une propagation de type prion.
Récemment, grâce aux avancées de la biologie structurale, il a été montré que plusieurs types de fibrilles (appelés polymorphes) peuvent être produits expérimentalement in vitro, à partir d’alpha-synucléine monomérique. La possibilité que ces différents polymorphes soient responsables des différentes présentations cliniques des synucléinopathies, fait encore l’objet d’intenses recherches.
Les scientifiques montrent que l’alpha-synucléine en solution saline peut adopter de manière stochastique plusieurs repliements amyloïdes et former autant de polymorphes. Certains de ces polymorphes étaient cependant, jusqu’à présent, passés inaperçus. En effet, ils ont découvert que, de manière inattendue, la sonde fluorescente thioflavine T (ThT), couramment utilisée dans le domaine pour détecter la fibrillogénèse de l’alpha-synucléine, ne détecte pas tous les polymorphes émergents, certains d’entre eux restant indétectables par cet outil de référence historique. Les chercheurs montrent que: (1) ces nouveaux polymorphes d’alpha-synucléine présentent une propension particulière à l’auto-réplication dans les neurones en culture, et (2) que, dans un modèle murin, leur injection in vivo, dans la substance noire, déclenche une synucléinopathie qui se propage sur de longues distances vers plusieurs structures cérébrales antérieures. Ces polymorphes ThT-négatifs ne correspondent à aucune des structures précédemment caractérisées. Ceci indique que des polymorphes, auparavant passés inaperçus, peuvent proliférer dans la population fibrillaire et être à l’origine d’une synulceinopathie particulièrement invasive.
Cette découverte est d’une importance particulière pour l’avancée de nos connaissances sur les synucléinopathies. Traditionnellement utilisée pour détecter les formes fibrillaires d’alpha-synucléine, la ThT a conduit à ignorer les polymorphes ThT-négatifs et a concentré l’essentiel de l’effort de recherche sur « la partie émergée de l’iceberg », c’est-à-dire les seules fibrilles ThT-positives.
Pour identifier rapidement à la fois les polymorphes ThT positifs et négatifs, les scientifiques. ont développé un test multiplex, le «Fibrilloscope». Ce test pourrait devenir un outil essentiel, en particulier pour éviter de confondre l’émergence de polymorphes ThT-négatifs avec des inhibitions de fibrillogénèse, lors de la recherche de thérapies inhibant l’agrégation de l’alpha-synucléine.
Cette étude démontre que l’émergence spontanée stochastique de polymorphes ThT-invisibles peut avoir lieu pendant la préparation standard de fibrilles d’alpha-synucléine. L’émergence de tels polymorphes peut-elle avoir lieu chez les patients et contribuer à la formation et la propagation des inclusions cytopathologiques dans les synucléinopathies? Soutenant cette possibilité, un autre groupe vient de montrer (https://www.nature.com/articles/s41586-020-1984-7), que les fibrilles d’alpha-synucléine amplifiées à partir d’échantillons de liquide céphalo rachidien provenant de patients atteints de MP présentaient un signal ThT bien plus important que celles amplifiées à partir d’échantillons de patients MSA.
La possibilité que des polymorphes fibrillaires « furtifs » d’alpha-synucléine – auparavant ignorés – puissent avoir une pertinence clinique, devrait stimuler un nouvel effort de recherche visant à les caractériser de manière approfondie.
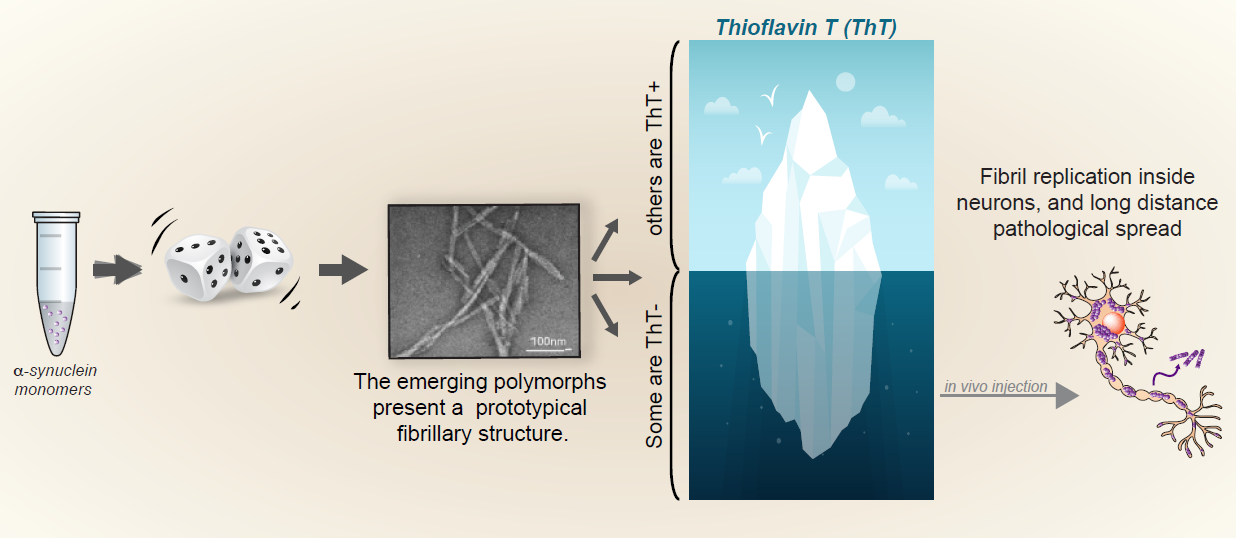
Figure : "Les fibrilles d' alpha-synucléine reconnues par la ThT constituent uniquement la partie émergée de l'iceberg: la génération stochastique de différents polymorphes fibrillaires aboutit également à la prolifération d'espèces "furtives" qui sont capables de se propager de manière aigue dans le cerveau
Pour en savoir plus:
Novel self-replicating α-synuclein polymorphs that escape ThT monitoring can spontaneously emerge and acutely spread in neurons.
De Giorgi F, Laferrière F, Zinghirino F, Faggiani E, Lends A, Bertoni M, Yu X, Grélard A, Morvan E, Habenstein B, Dutheil N, Doudnikoff E, Daniel J, Claverol S, Qin C, Loquet A, Bezard E, Ichas F.
Sci Adv. 2020 Oct 2;6(40):eabc4364. doi: 10.1126/sciadv.abc4364.
Contact
Laboratoire
Institut des Maladies Neurodégénératives (CNRS/Université de Bordeaux)
& Laboratoire de Neurosciences Expérimentales et Cliniques (Inserm/Université de Poitiers)