Prions et trimères d’Aß: convergence vers la formation de plaques Alzheimer
Les chercheurs ont identifié les trimères de peptides beta-amyloïdes (Aß) comme étant des agents auto-réplicatifs et nucléants responsables de la formation de plaques amyloïdes typiques de la maladie d’Alzheimer. Ces travaux sont publiés dans la revue Nature Communications.
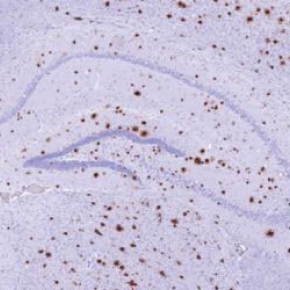
Les maladies à prions (la maladie de Creutzfeldt-Jakob et son variant chez l’homme, l’Encéphalopathie Spongiforme Bovine - ESB - ou maladie de la « vache folle » chez l’animal) sont caractérisées par l’accumulation dans le cerveau d’une protéine anormale, la protéine prion scrapie (PrPSc), qui est toxique pour les neurones.
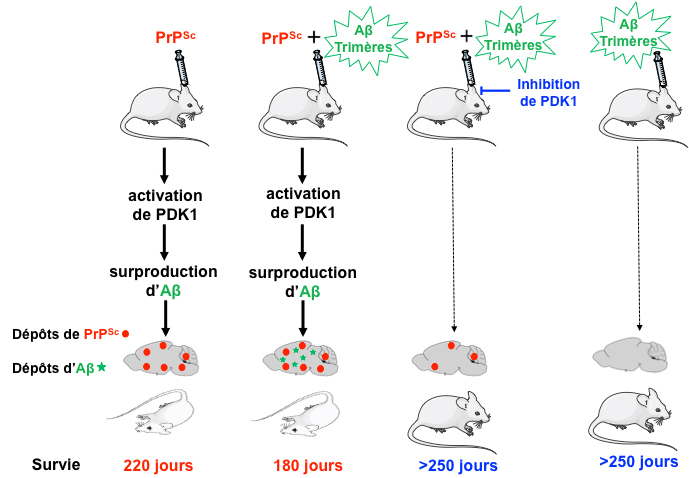
Dans ce travail, les chercheurs révèlent que l’infection par les prions de souris ou de neurones murins en culture induit une forte production d’une autre catégorie de peptides neurotoxiques, les peptides Aß caractéristiques de la maladie d’Alzheimer, selon un mécanisme qui dépend de la suractivation de la kinase PDK1. PDK1 suractivée provoque l’internalisation d’une enzyme protectrice, l’α-sécrétase TACE (ADAM17), qui ne peut plus cliver la protéine précurseur des peptides amyloïdes APP, favorisant alors la production des peptides Aß par les ß et γ-sécrétases.
Même si l’infection à prions mène systématiquement à une surproduction des peptides Aß par les neurones, leur dépôt dans le cerveau des souris n’est toutefois pas induit par la seule présence de PrPSc. Les chercheurs ont mis en évidence la présence de trimères de peptides Aß dans le liquide céphalo-rachidien des souris infectées par les prions. Ces trimères d’Aß, co-transmis avec la PrPSc, catalysent la formation de plaques amyloïdes Aß à l’origine d’une pathologie mixte PrPSc/Ab qui accélère la neurodégénérescence. L’inhibition de PDK1 permet de réduire la charge en protéines amyloïdes neurotoxiques, la PrPSc et les peptides Aß, et par conséquent les dépôts d’Aß dans le cerveau des souris infectées.
Les plaques Aß sont bien évidemment rares dans les maladies à prions. Il a été récemment reconnu que les plaques Aß trouvées dans le cerveau de patients ayant contracté une maladie de Creutzfeldt-Jakob suite à des injections d’hormone de croissance contaminée par les prions étaient liées à la présence de peptides Aß dans ces lots d’hormone. Il est important de noter que la seule injection des trimères d’Aß dans le cerveau des souris n’induit pas la formation de ces plaques amyloïdes. L’augmentation de production des peptides Aß induite par la PrPSc et la présence des trimères d’Aß doivent en fait converger pour la formation des plaques Aß.
Ces travaux dépassent vraisemblablement le cadre des seules maladies à prions et trouvent écho pour la maladie d’Alzheimer. Les mécanismes à l’origine des plaques Aß dans la maladie d’Alzheimer sont encore très peu élucidés. S’il s’avère que les trimères d’Aß sont aussi impliqués, ils pourraient alors constituer des biomarqueurs prédictifs de la formation des plaques amyloïdes et être un indicateur du degré de sévérité de la maladie d’Alzheimer.
© Mathéa Pietri & Benoit Schneider
Pour en savoir plus :
Production of seedable Amyloid-β peptides in model of prion diseases upon PrPSc-induced PDK1 overactivation.
Ezpeleta J, Baudouin V, Arellano-Anaya ZE, Boudet-Devaud F, Pietri M, Baudry A, Haeberlé AM, Bailly Y, Kellermann O, Launay JM, Schneider B.
Nat Commun. 2019 Aug 1;10(1):3442. doi: 10.1038/s41467-019-11333-3