Prévention « piquante » de l'infection par le VIH-1
La capsaïcine, composé épicé du piment, présente de nombreux avantages, qu’ils soient gustatifs ou médicaux. En effet, une étude parue dans la revue PNAS révèle une nouvelle fonction antivirale de la capsaïcine. Lors de sa transmission sexuelle, le virus de l'immunodéficience humaine de type 1 (VIH-1) cible en premier lieu les cellules immunitaires que sont les les cellules de Langerhans (CL) et les lymphocytes T CD4+ et résidant dans les épithéliums génitaux. Les scientifiques montrent qu’in vitro et ex vivo la capsaïcine est capable d’interagir aussi bien avec les deux types de cellules en bloquant l'infection par le VIH-1. Ces résultats suggèrent que des formulations contenant de la capsaïcine, déjà utilisée en clinique pour soulager la douleur, pourraient avoir leur utilité dans la lutte contre le VIH-1.
La capsaïcine, le composé épicé des piments, présente de nombreux avantages pour la santé et est utilisée en clinique. Elle peut par exemple contrôler l'inflammation, l'hypercholestérolémie, l'obésité, le cancer et l'hypertension. Au niveau moléculaire, la capsaïcine active le canal ionique « Transient Receptor Potential Vanilloid 1 (TRPV1) » qui est exprimé par des neurones périphériques appelés nocicepteurs, présents dans tous les tissus muqueux. Ces neurones sont responsables de la transmission des informations sur la douleur de la périphérie vers notre cerveau. C’est ce mécanisme qu’utilisent les aliments épicés provoquant une sensation de brûlure. En parallèle, l'activation de TRPV1 dans les nocicepteurs induit la sécrétion d’un neuropeptide à partir de leurs terminaisons nerveuses libres qui innervent tous les épithéliums muqueux. Ce neuropeptide, appelé « Calcitonin Gene-Related Peptide (CGRP) », est vasodilatateur. Il induit ainsi une dilatation des vaisseaux sanguins, expliquant pourquoi la consommation d'aliments épicés entraîne également des rougeurs.
Les nocicepteurs sont la principale source de CGRP, mais pas la seule : certaines cellules non neuronales, dont les cellules du système immunitaire, peuvent aussi sécréter du CGRP. Dans des études antérieures les scientifiques ont montré que les cellules de Langerhans (CL), cellules présentatrices d'antigènes résidentes dans les tissus muqueux, sécrètent du CGRP. De manière inattendue, ces études ont également démontré que le CGRP est doté d'importantes propriétés antivirales. En effet, le CGRP inhibe l'infection par le virus de l'immunodéficience humaine de type 1 (VIH-1). Au niveau cellulaire, le CGRP empêche le transfert des virions infectieux rapidement capturés par les CL aux lymphocytes T CD4+ qui sont les principales cibles cellulaires du VIH-1.
Dans cette étude publiée dans PNAS, les scientifiques se sont demandés si la sécrétion de CGRP par les CL était dépendante de l'activation de TRPV1, comme dans les nocicepteurs. Les expériences ont montré que c’était bien le cas, et qu’en conséquence, la capsaïcine pourrait prévenir l'infection par le VIH-1. L'étude montre d'abord que les CL humaines, qu'elles soient isolées des tissus muqueux du prépuce interne, un des sites génitaux ciblés par le VIH-1, ou différenciées in vitro des monocytes sanguins, expriment le TRPV1 fonctionnel à leur surface. De plus, le traitement avec de la capsaïcine des CL avant leur infection par le VIH-1 inhibe la formation de conjugués cellulaires entre les CL et les lymphocytes T CD4+, empêchant ainsi le transfert et l'infection des lymphocytes T CD4+ par le VIH-1 qui en résultent. Une telle inhibition implique l'activation de TRPV1, puisqu’un un inhibiteur de TRPV1 rétablit le transfert. Ensuite, l'étude révèle que la capsaïcine induit la sécrétion de CGRP par les CL, laquelle est partiellement responsable de l'inhibition du transfert du VIH-1.
Enfin, les scientifiques ont également testé les effets du CGRP et de la capsaïcine sur l'infection directe des lymphocytes T CD4+ par le VIH-1 en l'absence de CL. La capsaïcine, mais pas le CGRP, inhibe cette infection directe, indiquant que dans les Lymphocytes T CD4+, elle agit de manière indépendante du CGRP, bien que les lymphocytes T réagissent au CGRP dans d'autres contextes.
L'activation de TRPV1 dans les nocicepteurs par la capsaïcine est suivie d'une période réfractaire de longue durée, appelé « desensitization » associée à une absence de réponse à des stimuli nocifs supplémentaires. Sur la base de ces observations, des formulations à application locale contenant de la capsaïcine ont été développées et déjà approuvées pour un usage clinique comme analgésiques contre la douleur. Ces nouvelles découvertes suggèrent que de telles formulations pourraient être repositionnées afin de bloquer la transmission muqueuse du VIH-1 et offrir ainsi une stratégie neuro-immune originale et nouvelle pour limiter la transmission sexuelle du VIH-1.
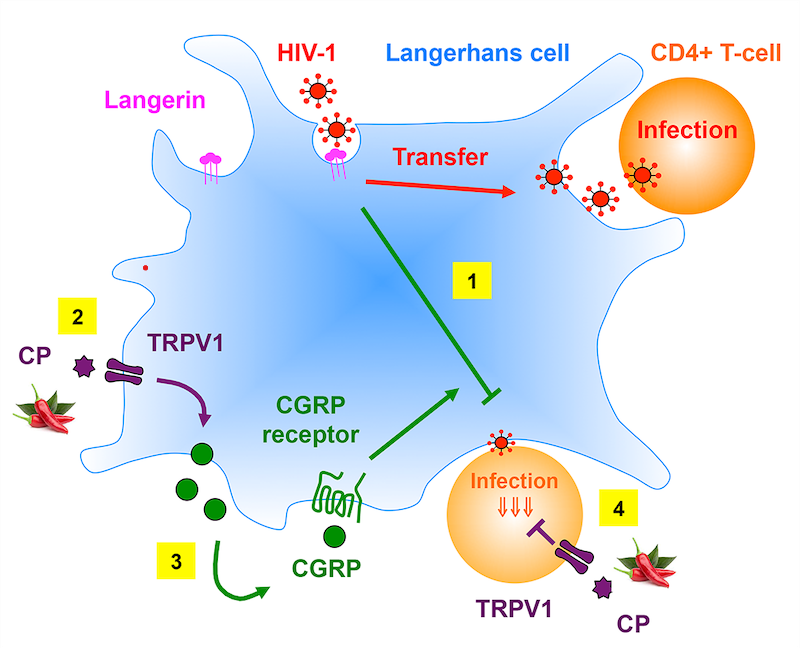
Figure : La capsaïcine (CP) inhibe l'infection par le VIH-1 des cellules de Langerhans (CL) et des lymphocytes T CD4+ muqueuses. (1) Dans les CL, la liaison du VIH-1 à la lectine langérine, un récepteur de reconnaissance de pathogène spécifique aux CL, induit l'internalisation et la dégradation du VIH-1. Les virions échappant à la dégradation sont ensuite transférés des CL et infectent les lymphocytes T CD4+. Des études antérieures du laboratoire ont montré que le CGRP active son récepteur exprimé par les CL et affecte une multitude de processus cellulaires et moléculaires (non illustrés), entraînant une inhibition significative du transfert muqueux du VIH-1 des CL aux lymphocytes T. (2) La présente étude montre que les CL humaines expriment le TRPV1 fonctionnel à leur surface. (3) De plus, lors de l'activation de TRPV1 par CP, les CL secrètent du CGRP, qui à son tour est partiellement responsables de l'inhibition du transfert du VIH-1 des CL aux lymphocytes T CD4+. (4) Le CP, mais pas le CGRP, inhibe également l'infection directe des lymphocytes T CD4+ par le VIH-1.
Pour en savoir plus :
TRPV1 activation in human Langerhans cells and T-cells inhibits mucosal HIV-1 infection via CGRP-dependent and independent mechanisms.
Jammy Mariotton , Emmanuel Cohen, Aiwei Zhu, Cédric Auffray, Caio César Barbosa Bomfim, Nicolas Barry Delongchamps, Marc Zerbib , Morgane Bomsel, Yonatan Ganor Y.
PNAS. 2023. May 30. DOI:10.1073/pnas.2302509120
Contact
Laboratoire
Institut Cochin (CNRS / Université Paris Cité)
22, rue Méchain
75014 Paris
