Plasticité et sophistication de l'acétylation N-terminale des protéines chez les plantes
L’acétylation N-terminale des protéines est la modification protéique la plus fréquente après la phosphorylation. Cependant, la plupart des études sur cette modification essentielle ont été menées sur des levures et des métazoaires. Une séries d’articles publiés récemment par un consortium international a permis d’élucider la machinerie des acétyltransférases N-terminales des organismes photosynthétiques ainsi que leur rôle biologique critique dans le développement, la translocation et la stabilité des protéines ou la réponse à de nombreux stress abiotiques et biotiques. Ces études pourraient avoir un impact significatif sur la recherche fondamentale et appliqué en fournissant de nouvelles cibles pour la sélection et le développement de nouvelles génération de plantes, de biocarburants ou d'usines de production de drogues.
Les modifications post-traductionnelles (PTMs) des protéines constituent un domaine d'étude émergent et significatif avec un fort potentiel d'impact dans de nombreux domaines de la biologie. La modulation de l'activité des protéines via les PTMs joue un rôle fondamental dans la régulation du développement et la tolérance au stress. L'acétylation N-terminale des protéines est l'une de ces modifications. Pourtant, on avait peu d’informations de cette modification essentielle et sa machinerie chez les organismes photosynthétiques.
En 2018, un consortium international porté par cinq laboratoires issus de quatre pays européens (Allemagne, Finlande, France et Royaume Uni) avait comme objectif, dans le cadre du projet "KatNat", de clarifier les multiples fonctions de l'acétylation des protéines chez les plantes. Ce consortium vient de publier une série de 4 articles révélant que la machinerie d'acétylation N-terminale des plantes présente des propriétés similaires mais aussi bien distinctes de celle des métazoaires et des champignons.
La caractérisation de cette modification dans le cytosol de la plante modèle Arabidopsis thaliana a mis en évidence l'importance de l'acétylation N-terminale dans la gestion de la tolérance au stress abiotique, de l'immunité aux agents pathogènes et dans le contrôle de la stabilité des protéines. De plus les scientifiques ont pu identifier une famille d'acétyltransférases codées par le génome nucléaire puis relocalisées dans les plastes (article 1). Cette famille présente un grand nombre de propriétés très distinctes de la machinerie cytosolique, que le consortium a caractérisé en parallèle (articles 2,3,4). La caractérisation de ces acétyltransférases du chloroplaste a ainsi révélé par exemple que les mêmes acteurs sont capables de garantir à la fois l’acétylation N-terminale et celle interne des lysines. Chacune des activités acétyltransférase du chloroplaste révèle des spécificités distinctes et inattendues.
Ces nouvelles données suggèrent que la machinerie multitâche à la base de l’acétylation N-terminale des protéines des plastes et celle du cytosol ont évolué pour répondre aux besoins très spécifiques des organismes photosynthétiques comme les végétaux et joue un rôle dans le contrôle de leur développement et de l’adaptation au stress.
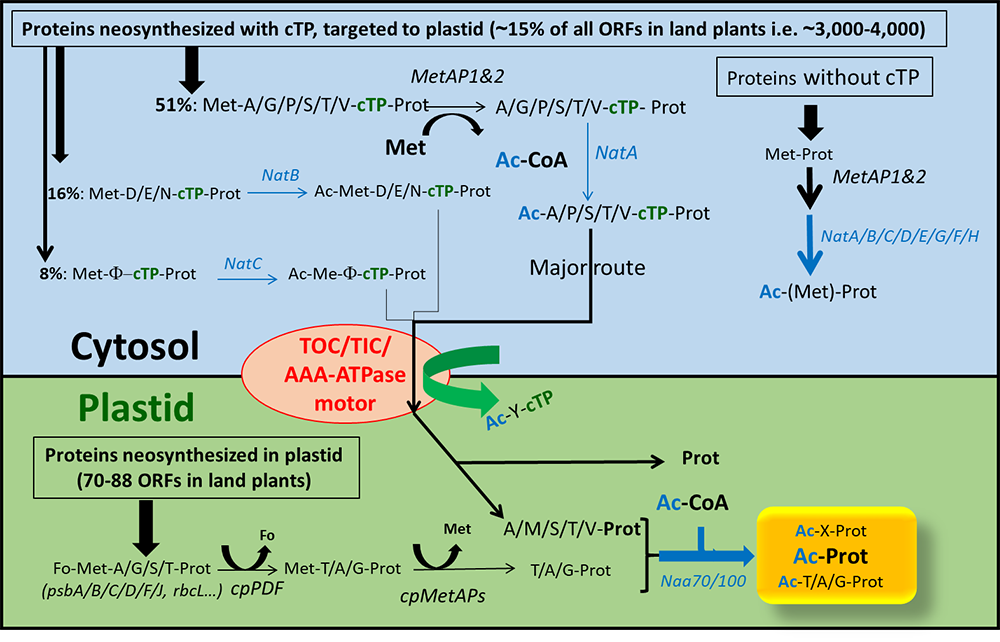
Figure: Les différentes voies de modification N-terminales des protéines impliquant des NATs chez les plantes. La boîte bleue schématise la machinerie cytosolique de synthèse des protéines issues du génome nucléaire. Sur le côté droit est résumé ce qui se passe pour les protéines qui ne transitent pas vers le plaste (sans tenir compte de celles secrétées ou exportées vers les mitochondries). Sur le côté gauche, les protéines qui sont ciblées sur le plaste (15% du génome nucléaire) sont spécifiées et leur potentiel d'acétylation suivant les trois principales voies d'acétylation N-terminale est indiqué. La voie principale menant à l'importation dans le plaste est indiquée en gras. Les composants des machines d'importation de membrane plastidique sont colorés en rouge. L'encadré vert montre la traduction du génome plastidique (à gauche) et la machinerie d'acétylation résultante, qui prend également en compte les protéines transformées importées du cytosol.
Pour en savoir plus:
1) NatB-Mediated N-Terminal Acetylation Affects Growth and Biotic Stress Responses.
Huber M, Bienvenut WV, Linster E, Stephan I, Armbruster L, Sticht C, Layer D, Lapouge K, Meinnel T, Sinning I, Giglione C, Hell R, Wirtz M.
Plant Physiol. 2020 Feb;182(2):792-806.https://doi.org/10.1104/pp.19.00792 Epub 2019 Nov 19
2) The Arabidopsis Nα-acetyltransferase NAA60 locates to the plasma membrane and is vital for the high salt stress response.
Linster, E., Layer, D. Bienvenut, W.V., Dinh, T., Weyer, F., Lemhuis, W., Brünje, A., Hoffrichter, M., Miklankova, P., Sindlinger, J., Schwarzer, D., Lapouge, K., Meinnel, T., Finkemeier, I. Giglione, C., Hell, R., Sinning, I., Wirtz, M.
New Phytol 16 juin 2020. https://doi.org/10.1111/nph.16747
3) Dual lysine and N-terminal acetyltransferases reveal the complexity underpinning protein acetylation
Bienvenut, W.V., Brünje, A., Boyer, J.-B., Bernal, G., Lassowskatb, I., Dian, C., Mühlenbeckb, J.S., Linster, E., Dinh, T.V., Koskela, M.M., Jung, V. Schyrbab, L.K., Ivanauskaited, A., Hell, R., Mulo, P., Wirtz, M., Meinnel, T., Giglione, C., & Finkemeier, I
Mol Syst Biol 7 july 2020. https://doi.org/10.15252/msb.20209464
4) NAA50 is an enzymatically active Nα-acetyltransferase that is crucial for the development and regulation of stress responses
Armbruster L, Linster E, Boyer J-B, Brunje A, Eirich J, Stephan I, Bienvenut WV, Weidenhausen J, Meinnel T, Hell R, Sinning I, Finkemeier I, Giglione C, Wirtz M
Plant Physiol Mai 2020. DOI: https://doi.org/10.1104/pp.20.00222
Contact
Laboratoire
Institut de biologie intégrative de la cellule (I2BC) - CNRS/CEA/Université Paris-Saclay
CNRS - Bât 21/22/23/24/26/34/14
1 Avenue de la Terrasse
91198 GIF SUR YVETTE CEDEX