Nouvelles perspectives thérapeutiques pour les Maladies Inflammatoires Chroniques de l’Intestin
Les Maladies Inflammatoires Chroniques de l’Intestin, ou MICI, touchent plus de 250 000 personnes en France. Bien que les traitements pour contrer l’inflammation améliorent considérablement la situation des patients, une rémission complète n’est observé dans moins de la moitié des cas. Dans une étude publiée dans Cell, des scientifiques montrent qu’une sécrétion prolongée d’interférons de type III, une protéine normalement produite suite à une infection virale, est responsable de cette absence de guérison complète.
Les maladies inflammatoires chroniques de l’intestin (MICI) regroupent la maladie de Crohn et la rectocolite hémorragique aigue. Elles se caractérisent par une inflammation de la paroi du tube digestif liée à une dérégulation du système immunitaire intestinal. Ces maladies touchent plus de 250 000 patients en France.
Interféron de type III : Un frein à la réparation de la muqueuse intestinale
Jusqu'à présent, la plupart des traitements se sont concentrés sur la réduction de l'inflammation. Bien que les thérapies biologiques et les médicaments anti-inflammatoires aient considérablement amélioré les symptômes des patients atteints de MICI, seuls 50 % d'entre eux obtiennent une rémission complète. Les autres souffrent souvent d'une cicatrisation incomplète de la muqueuse intestinale et de rechutes fréquentes.
Dans un article publié dans la revue Cell, des scientifiques ont découvert un mécanisme clé qui ralentit la réparation des tissus dans les intestins lors de l’inflammation. Cette découverte ouvre la voie à la conception de traitements qui pourraient aider ces patients à mieux réparer leurs intestins et atteindre une rémission complète.
Les scientifiques ont identifié qu'une protéine appelée interféron lambda ou interferon de type III (IFN-λ) joue un rôle crucial dans le retard de la guérison intestinale. Normalement, l'IFN-λ aide à lutter contre les virus en empêchant leur réplication, mais chez les personnes atteintes de MICI, cette protéine est produite en quantités anormales pendant l'inflammation. Dans les intestins chroniquement enflammés de ces patients, l'IFN-λ peut bloquer le processus de réparation, retardant ainsi la rémission.
Un mécanisme clé identifié.
En utilisant différents modèles de souris transgéniques, mais aussi des organoïdes intestinaux (des « mini-intestins » cultivés à partir de cellules de patients dans une boîte de culture), les scientifiques ont pu retracer la voie moléculaire activée par l'IFN-λ. Ils ont découvert que l'IFN-λ est anormalement élevé chez les patients atteints de MICI, ce qui conduit à la production accrue d'une autre protéine, ZBP1, dans les cellules intestinales. ZBP1 active une cascade qui détruit les cellules souches intestinales, les empêchant de régénérer la couche épithéliale.
Ce mécanisme est apparu au cours de l’évolution pour tuer les cellules infectées par un virus, mais au cours des réponses inflammatoires dérégulées typiques de la MICI, il peut être activé même en l'absence d'infection virale. En effet, les scientifiques ont démontré que dans ces conditions, le signal qui active ZBP1 et induit la mort cellulaire provient de l'état inflammatoire des patients.
Surtout, en utilisant des modèles organoïdes qui font la distinction entre la phase d'inflammation aiguë et la phase de réparation, ils ont réalisé que ce mécanisme qui est actif pendant l'inflammation aiguë, le reste pendant la phase de réparation de la muqueuse. Cette découverte est particulièrement importante dans un contexte thérapeutique, car les thérapies actuelles peuvent calmer l'inflammation mais n'aboutissent souvent pas à une guérison complète.
Ces découvertes ouvrent la voie à une nouvelle approche thérapeutique : en bloquant les interférons de type III, il pourrait être possible de restaurer la barrière intestinale, améliorant ainsi la qualité de vie des patients et réduisant le risque de complications graves.
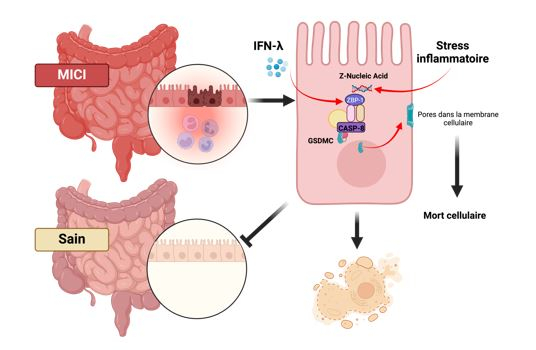
Figure : L'interféron lambda empêche la réparation dans les MICI. Les interférons lambda (IFN-λ) sont augmentés dans les muqueuses des patients atteints de MICI. Ils augmentent, dans les cellules épithéliales, les niveaux de ZBP1. ZBP1 est activé par les "acides nucléiques en Z" qui sont augmentés pendant le stress inflammatoire. ZBP1 déclenche la mort cellulaire en activant la caspase 8 (CASP-8) qui, à son tour, active GSDMC et tue les cellules en formant des pores dans la membrane cellulaire. Ce processus empêche la réparation des muqueuses et le retour à une condition saine. Image généré avec Biorender.
En savoir plus : Type III interferons induce pyroptosis in gut epithelial cells and impair mucosal repair. Jena, K.K., Mambu, J., Boehmer, D., Sposito, B., Millet, V., de Sousa Casal, J., Muendlein, H.I., Spreafico, R., Fenouil, R., Spinelli, L., et al. (2024). Cell. https://doi.org/10.1016/j.cell.2024.10.010.
Contact
Laboratoire
Centre d'immunologie de Marseille-Luminy - CIML (Aix-Marseille Université/CNRS/Inserm)
163 avenue de Luminy Case 906
13288 Marseille cedex 9 France
