Neurogénine 1 et neuro-morphogénèse de l’organe sensoriel olfactif chez le poisson-zèbre
Au cours du développement d’un organe, la différenciation contrôlée produit les bons types cellulaires tandis que la morphogenèse des tissus crée la bonne structure 3D pour soutenir la fonction. Comment ces deux processus apparemment indépendants sont-ils coordonnés? Une étude publiée dans la revue Development utilisant la formation de l’épithélium olfactif chez l’embryon de poisson zèbre comme paradigme et des méthodes d’imagerie et d’édition du génome a montré que l’acteur majeur qui lie l’identité « neurone olfactif » et sa migration est le facteur de transcription Neurogénine.
La morphologie des organes sensoriels crâniens est parfaitement adaptée à la détection de stimuli spécifiques. Au cours du développement embryonnaire, les mouvements morphogénétiques sculptent ces structures et des types cellulaires seront spécifiés pour participer à leur fonction soit en détectant des stimuli spécifiques, soit en transmettant des informations sensorielles au cerveau. Les mécanismes moléculaires qui contrôlent ces processus indépendamment commencent à être bien caractérisés, cependant ceux qui permettent leur couplage reste encore mal connus.
Les chercheurs ont utilisé la mise en place de l’épithélium olfactif chez l’embryon de poisson zèbre pour mettre à jour ces processus. Dans ce système, deux vagues de neurogénèse produisent les neurones olfactifs pionniers (EON) puis les neurones olfactifs sensoriels d'une manière qui nécessite les facteurs de transcription Neurogénine1 (Neurog1) et Neurod4. En parallèle, l’organe olfactif se forme : les neurones pionniers se positionnent initialement en fer à cheval puis, un processus de migration contrôlé par une protéine attractante (Cxcl12a) et son récepteur (Cxcr4b) permettra leur organisation en rosette. L’ensemble de ces processus complexes ne prendra que 12 heures. Existe t-il un lien entre l’identité neuronale contrôlée par Neurog1 et les mouvements morphogénétiques qui forment l’épithélium olfactif ?
Pour répondre à cette question, les scientifiques ont utilisé la transparence de l’embryon de poisson zèbre pour filmer en 3 dimensions et en temps réel la migration des neurones olfactifs pionniers à l’aide de lignées transgénique marquant cette population neuronale. Grâce à des techniques d’analyse d’image extensives, ils ont pu caractériser les mouvements migratoires de ces neurones et montrer que dans des embryons mutants pour neurog1, la trajectoire des EONs est perturbée surtout dans la partie la plus antérieure de la structure. De plus, des défauts similaires chez les mutants cxcr4b et cxcl12a ont été mis en évidence. Chez les mutants neurog1, l'expression de cxcr4b (mais pas de cxcl12a) est réduite ou perdue précocement, lors de cette phase de migration. Les chercheurs ont alors montré que la restauration de l'expression précoce de cxcr4b chez les mutants du neurog1 sauvait le phénotype de migration.
Enfin, au niveau moléculaire, les auteurs ont identifié un groupe de séquences CAGATG en amont de cxcr4b qui est directement régulé par Neurog1. Ils ont finalement utilisé la technique d’édition du génome Crispr-cas9 pour éliminer cet élément dans une lignée permettant de visualiser l’expression de cxcr4b. Ils ont pu mettre en évidence que la perte de cet élément entraine spécifiquement la perte d’expression de cxcr4b.
Ainsi, Neurog1 coordonne la neurogenèse et la morphogenèse via Cxcr4b pour mettre en place l’identité et la forme de l’organe olfactif au cours du développement.
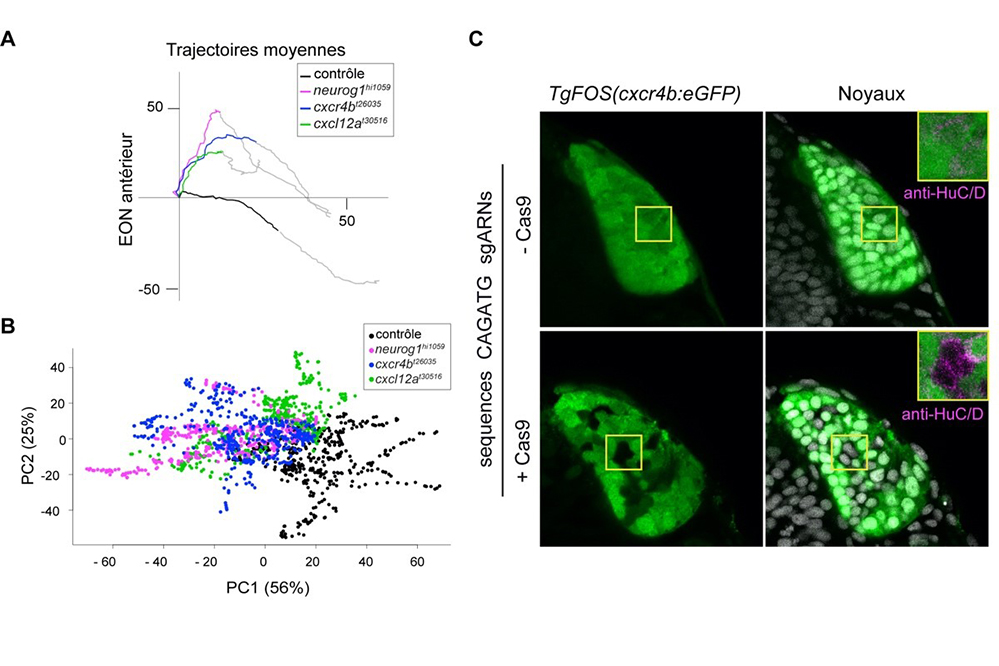
Figure : Les défauts morphogénétiques des embryons mutants cxcr4b et cxcl12a ressemblent à ceux de neurog1 et Neurog1 contrôle directement l'expression de cxcr4b via un élément CAGATG. (A) Trajectoires moyennes montrant la migration des EON antérieurs dans les embryons contrôle (Noir) et mutants pour neurog1 (Magenta), cxcr4b (Bleu) et cxcl12a (Vert). (B) Analyse en composante principale des paramètres morphogénétiques extraits des ensembles de données précédentes montrant que les trajectoires contrôle (Noir) sont clairement séparées des autres conditions. (C) Sections confocales uniques d'embryons TgFOS(cxcr4b:eGFP) à 24 hpf montrant l'expression de l'eGFP dans les rosettes olfactives, ou l'expression d’un marqueur pan neuronal (HuC/D) ou un marquage nucléaire. Les embryons ont été injectés avec une paire d'ARN guide (sgRNA) flanquant l’élément CAGATG au locus cxcr4b plus ou moins Cas9 comme témoin. Les encadrés jaunes montrent l'expression de HuC/D dans les deux conditions.
L'imagerie en temps réel révèle une migration des EON vers le centre de la future rosette olfactive.
Film montrant une série d'acquisition des EON marqués en vers (lignée transgénique: Tg(-8.4neurog1:gfp) ) dans un embryon contrôle. Le film montre l'acquisition complète de 12 à 27 hpf avec des images toutes les 7 min pour montrer la formation de la rosette olfactive qui donnera l'organe sensoriel olfactif.
© Raphaël Aguillon
Audiodescription
Pour en savoir plus :
Morphogenesis is transcriptionally coupled to neurogenesis during peripheral olfactory organ development.
Aguillon R, Madelaine R, Aguirrebengoa M, Guturu H, Link S, Dufourcq P, Lecaudey V, Bejerano G, Blader P, Batut J. Development. 2020 Nov 3:dev.192971. doi: 10.1242/dev.192971.
Contact
Laboratoire
Centre de Biologie Intégrative (CBI), Centre de Biologie du Développement (CBD) - (CNRS/Université Paul Sabatier)
Bâtiment 4R4, Université Paul Sabatier
118 Route de Narbonne 31062 Toulouse
