Migration de cellules dans le cerveau de poisson : un duel entre Notch et FGF
Dans l’organisme, différent types de cellules doivent en permanence se déplacer et, pour plus d’efficacité, elles migrent généralement en groupe. Pour coordonner leur migration, les cellules doivent intégrer divers signaux présents dans leur environnement mais ce processus reste mal compris. En étudiant la migration des cellules de la parapinéale dans le cerveau asymétrique du poisson zèbre, les chercheurs ont montré que la signalisation Notch contrôle la migration des cellules via sa capacité à limiter l’activation de la voie FGF à quelques cellules situées préférentiellement au front de migration. Cette étude a été publiée dans la revue elife.
Que ce soit au cours de l’embryogenèse ou chez l’adulte, par exemple lors de la réparation de tissus endommagés, divers groupes de cellules doivent en permanence migrer dans l’organisme vers les sites ou leur fonction est requise. Pour une plus grande efficacité, les cellules se déplacent généralement en groupe. Pour migrer, les groupes de cellules doivent intégrer des signaux environnants et communiquer entre elles pour coordonner leur déplacement mais ces processus restent mal compris.
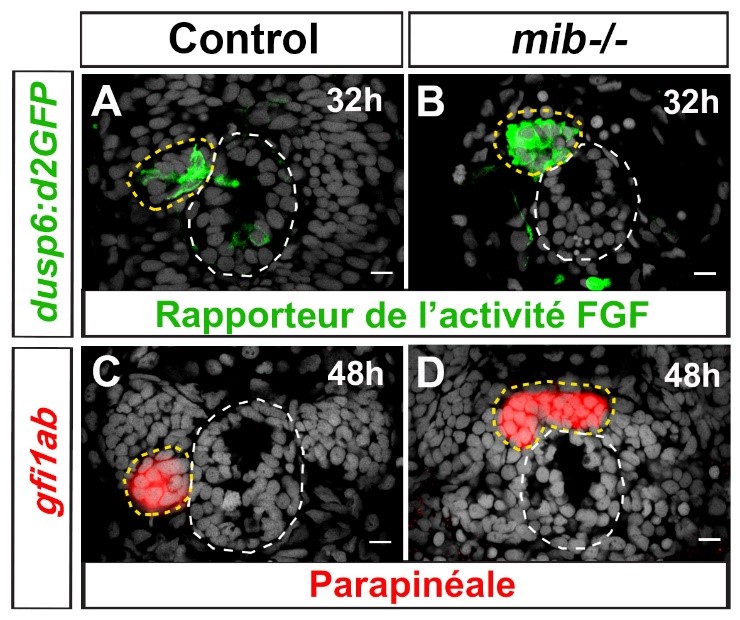
L’embryon de poisson-zèbre est un modèle de choix pour étudier la migration collective car, étant transparent, il permet de visualiser la migration de cellules en temps réel et offre une palette d’outils génétiques et pharmacologiques pour moduler l’activité de facteurs d’intérêt. Le modèle d’étude, la parapinéale, est un petit groupe de neurones qui migrent de la ligne médiane vers le côté gauche du cerveau lors de la mise en place de l’asymétrie gauche droite du cerveau. La migration de la parapinéale requiert l’activation de la voie de signalisation FGF par le facteur Fgf8. Cependant, bien que toutes les cellules de la parapinéale soient théoriquement capables de répondre au signal Fgf8, seules quelques cellules, généralement situées du côté gauche de la parapinéale, répondent à ce signal en activant la voie FGF. Cette restriction de l’activité FGF au front de migration est essentielle pour la migration de la parapinéale mais les mécanismes par lesquels l’activation de la voie FGF est limitée à quelques cellules n’etaient pas connus.
Les résultats montrent que la voie de signalisation Notch est nécessaire pour réguler l’activation de la voie FGF dans les cellules de la parapinéale et permettre leur migration collective. En effet, l'inactivation de la voie Notch entraîne une augmentation du nombre de cellules qui activent la voie du FGF menant à des défauts de migration de la parapinéale. L'activation ectopique de la voie Notch entraîne à l’inverse une forte réduction de l’activité FGF et mène également à des défauts de migration. Enfin, une diminution ou une augmentation du niveau de signalisation du FGF peut respectivement améliorer ou aggraver le défaut de migration parapinéale provoqué par la perte de fonction de Notch.
Ces données indiquent que la signalisation Notch contrôle finement la migration des cellules de la parapinéale via sa capacité à limiter l’activation de la voie du FGF à quelques cellules. Elles montrent également que la voie Notch est requise pour contrôler la spécification des cellules de la parapinéale et que ce rôle est indépendant de la fonction de Notch dans la migration des cellules de la parapinéale et de sa capacité à moduler l’activité FGF. D’autres études seront nécessaires pour comprendre comment la signalisation Notch peut limiter l’activité FGF à quelques cellules seulement au sein de la parapinéale.
© Myriam Roussigné & Lu Wei
En savoir plus
Notch signaling restricts FGF pathway activation in parapineal cells to promote their collective migration.
Wei L, Al Oustah A, Blader P, Roussigné M.
Elife. 2019 Sep 9;8. pii: e46275. doi: 10.7554/eLife.46275.