Mieux comprendre les mécanismes des cancers cérébraux pédiatriques avec la drosophile
Les cancers cérébraux représentent environ 25 % de tous les cancers chez les enfants, mais moins de 2 % chez les adultes, ce qui suggère que le cerveau en développement est particulièrement sujet à la transformation cancéreuse. Toutefois, les raisons sous-jacentes ne sont pas encore clairement identifiées. Dans une récente étude publiée dans la revue eLife, des chercheurs travaillant sur la drosophile ont identifié un programme génétique opérant lors de la fabrication du cerveau, qui peut être détourné pour induire des tumeurs s’apparentant à des cancers pédiatriques, et régir leur hétérogénéité cellulaire.
Chez le fœtus, lors de la fabrication du cerveau, les cellules souches et progéniteurs neuraux subissent des périodes de forte prolifération selon une séquence très stéréotypée. Il a été observé que les cancers pédiatriques du système nerveux central sont souvent initiés pendant ces périodes très limitées de prolifération. Cependant, les causes de ces cancers et la manière dont ils sont régulés sont toujours très mal comprises.
La drosophile possède l’avantage d’avoir un cerveau dont la fabrication est beaucoup plus simple que chez les mammifères, et beaucoup mieux comprise. Notamment, ces dernières années a été identifié un programme génétique délimitant les fenêtres temporelles pendant lesquelles les cellules souches neurales prolifèrent. Combinant des approches de génétique, séquençage de cellule unique et modélisation numérique, les chercheurs ont découvert que ce programme, dit de « spécification temporelle », est redéployé dans des tumeurs neurales induites lors du développement larvaire de la drosophile, un stade s’apparentant aux stades fœtaux chez les mammifères. Dans ces tumeurs, qui finissent par tuer la mouche adulte, les gènes de spécification temporelle structurent l’organisation cellulaire de la tumeur selon une hiérarchie finement contrôlée. Cette hiérarchie permet de créer une hétérogénéité au sein des cellules tumorales, en régulant notamment leur métabolisme et leur potentiel prolifératif. La conséquence est que la croissance tumorale est propagée indéfiniment par une petite population de cellules présentant un fort métabolisme, appelées cellules souches cancéreuses.
En identifiant les gènes responsables de cette organisation hiérarchique, et sachant que ces derniers sont conservés au cours de l’évolution, cette étude ouvre la voie à une meilleure compréhension des mécanismes favorisant l’apparition et le maintien des cellules souches cancéreuses dans les cancers de l’enfant.
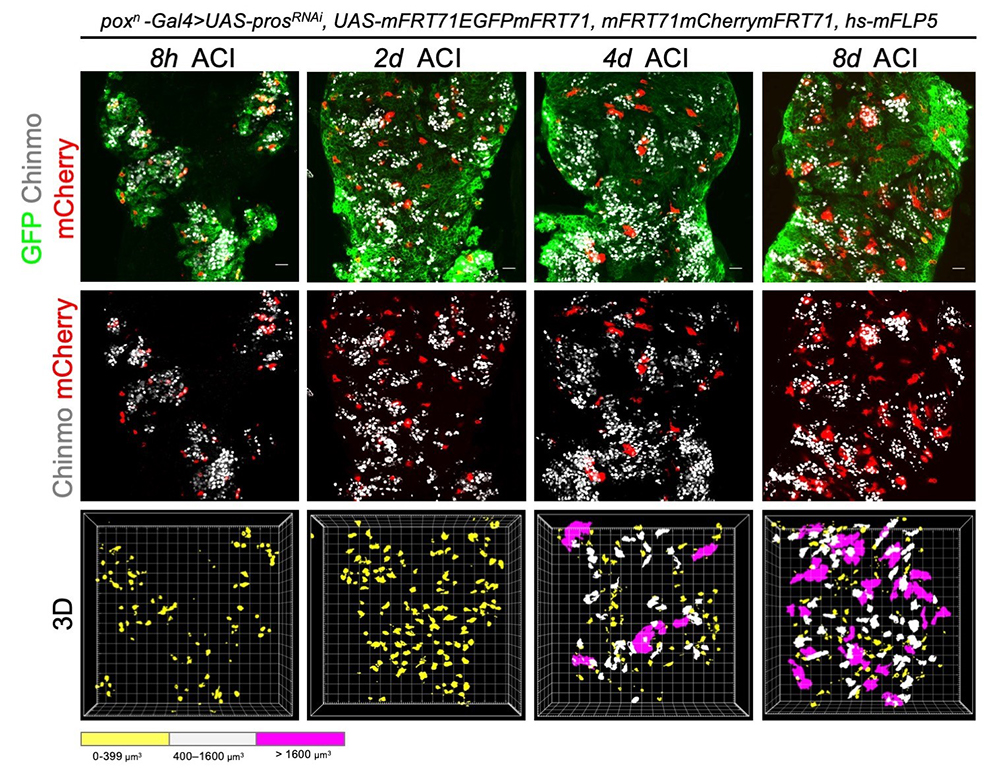
Figure : Étude de lignages au sein des tumeurs. La figure montre des clones de cellules (en rouge) au sein de tumeurs (vert) induites dans le système nerveux de larve de drosophile. Le suivi et l’analyse de ces clones sur 8 jours a permis d’établir un modèle numérique de croissance clonale démontrant l’organisation hiérarchique des tumeurs. En combinant ce modèle a une approche de séquençage de cellules uniques, les chercheurs ont pu identifier le réseau de gènes exprimés le long de cette hiérarchie cellulaire.
Pour en savoir plus :
Coopted temporal patterning governs cellular hierarchy, heterogeneity and metabolism in Drosophila neuroblast tumors.
Genovese S, Clement R, Gaultier C, Besse F, Narbonne-Reveau K, Daian F, Foppolo S, Luis N,M, Maurange C
eLife 2019;8:e50375 . DOI: 10.7554/eLife.50375