Maladie d’Alzheimer : une modification de la protéine tau induisant les agrégats fibrillaires identifiée
Le diagnostic post-mortem de la maladie d’Alzheimer repose sur l’analyse immunohistologique réalisée avec l’anticorps AT8 dirigé contre la protéine neuronale tau phosphorylée. Des chercheurs de l'unité de glycobiologie structurale et fonctionnelle et du laboratoire d'ingénierie des systèmes biologiques et des procédés démontrent que l’épitope reconnu par cet anticorps induit de façon robuste l’agrégation de tau. Cette étude qui ouvre de nouvelles perspectives thérapeutiques, a été publiée le 22 août 2017 dans la revue PNAS.
Afin de déterminer avec certitude si un(e) patient(e) était atteint(e) de la maladie d’Alzheimer, un examen histologique est pratiqué post-mortem au cours duquel on recherche, sur des coupes du cerveau, la présence et la localisation de structures protéiques fibrillaires. L’anticorps utilisé s’appelle AT8, et l’on pensait connaître avec précision la séquence des acides aminés qu’il reconnaît sur la protéine neuronale tau, facteur important dans la stabilisation des microtubules, mais également constituant principal des fibrilles intracellulaires qui caractérisent le cerveau malade. AT8 reconnaît l’épitope centré sur les acides aminés Ser202 et Thr205 dans cette protéine, après leur phosphorylation par des kinases neuronales. Récemment, néanmoins, des données cristallographiques ont mené à une caractérisation plus fine de l’épitope, qui inclut un troisième acide aminé phosphorylé, la Ser208. Ainsi l’épitope triplement phosphorylé serait reconnu par AT8 avec une meilleure affinité que l’épitope doublement phosphorylé.
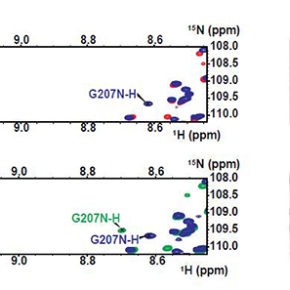
Caroline Smet-Nocca et Guy Lippens ont prouvé, dans un projet collaboratif impliquant les équipes de Yves Jacquot (Université P. et M. Curie, Paris), et Etienne-Emile Baulieu (Inserm UMR 1195, Kremlin-Bicêtre), que l’épitope de l’anticorps AT8 joue un rôle actif dans l’agrégation de la protéine Tau en l’absence d’une phosphorylation inhibitrice. Ils démontrent par résonance magnétique nucléaire (RMN), fluorescence et microscopie électronique qu’une phosphorylation de l’épitope AT8 limitée aux résidus Ser202 et Thr205 induit un tournant dans la protéine tau qui empêche l’agrégation, tandis que la phosphorylation supplémentaire de la Ser208 déstabilise cette conformation locale et mène vers l’agrégation.
Alors qu’elle est réalisée in vitro, l’agrégation de la protéine tau phosphorylée conduit à la formation de fibrilles morphologiquement similaires à celles issues des cerveaux de patients atteints de la maladie d’Alzheimer. Cette étude met au premier plan la phosphorylation de la protéine tau dans le processus pathologique. Elle ouvre ainsi la voie vers l’identification des kinases impliquées dans ces phosphorylations spécifiques et vers une compréhension plus précise des mécanismes de l’agrégation avec, comme perspectives, de nouvelles pistes thérapeutiques.
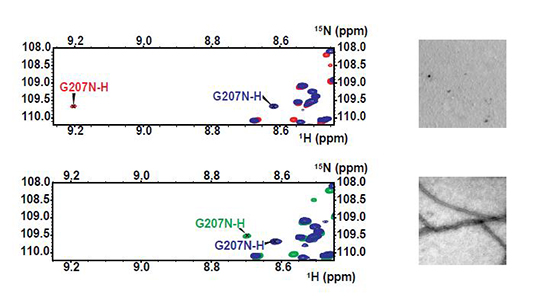
© Caroline Smet-Nocca, Guy Lippens
En savoir plus
-
Identification of the Tau phosphorylation pattern that drives its aggregation.
Despres C, Byrne C, Qi H, Cantrelle FX, Huvent I, Chambraud B, Baulieu EE, Jacquot Y, Landrieu I, Lippens G, Smet-Nocca C.
Proc Natl Acad Sci U S A. 2017 Aug 22;114(34):9080-9085. doi: 10.1073/pnas.1708448114.