Les voies de transport intracellulaire : de nouvelles applications ?
L’activité des cellules requiert la fabrication et le transport de protéines vers différents compartiments. Ces protéines sont parfois la cause de maladies ou la porte d’entrée de certains pathogènes. Grâce à un système permettant de suivre le transport de ces protéines, des collections de composés chimiques ont été criblées pour identifier des molécules perturbant ce transport. Cette approche a été appliquée à l’infection par le VIH. Ces travaux ont été publiés dans Science Advances.
Pour contrôler leur activité et assurer leurs fonctions, nos cellules ont besoin en permanence de fabriquer des nouvelles protéines qui sont transportées de façon très précise vers les compartiments cellulaires où elles sont actives, comme les lysosomes ou la membrane plasmique. Les échanges que les cellules entretiennent avec l’environnement (capture de nutriments, émission de signaux ou interactions avec d’autres cellules par exemple) dépendent de voies de transport intracellulaire efficaces et contrôlées. Le rôle fondamental de ces voies fait que leur dysfonctionnement est souvent associé au développement de pathologies (problèmes d’inflammation, de métabolisme, de développement ou cancers). En outre, certaines de ces protéines sont utilisées comme point d’entrée par des pathogènes, comme des bactéries ou des virus. Trouver un moyen de contrôler ou de perturber spécifiquement le transport de ces protéines représente donc un enjeu thérapeutique important.
Pendant de nombreuses années, le modèle le plus utilisé pour décrire ces voies de transport postulait que la sécrétion – le transport des protéines vers la membrane plasmique – se faisait par défaut. Il semblait donc peu probable de perturber le transport d’une protéine sans perturber la sécrétion dans son ensemble. Aujourd’hui, il est bien établi que de nombreuses voies de transport existent et il est donc envisageable de perturber sélectivement le transport d’une protéine mise en jeu dans le développement d’une pathologie.
Afin de suivre spécifiquement le transport de certaines protéines dans des cellules gardées en culture, les chercheurs ont développé un système d’analyse quantitatif du trafic intracellulaire nommé système RUSH. Ce système a été utilisé pour cribler à haut débit de larges collections de composés chimiques (chimiothèques) par imagerie cellulaire automatisée. Ces techniques de criblage utilisent des robots de pipetage et des systèmes d’imagerie cellulaire automatisés, couplés à des algorithmes d’analyse d’images et des méthodes d’analyse de grands jeux de données.
Le système RUSH a ainsi été utilisé pour découvrir des inhibiteurs spécifiques du transport de protéines impliquées dans le développement de pathologies humaines et notamment la protéine CCR5, corécepteur du virus VIH, l’agent du SIDA.
Des petites molécules inhibant le transport de la protéine CCR5 à la surface des cellules ont été identifiées. Ces molécules ont été caractérisées, leur mode d’action analysé et leurs effets sur l’infection par le VIH étudié in vitro. Leur spécificité d’action a ainsi été confirmée et le mode d’action de certaines d’entre elles élucidé. Surtout, il a été mis en évidence que des cellules primaires humaines, cibles de l’infection par le VIH (des macrophages) sont partiellement protégées de l’infection par le VIH grâce à ces molécules.
Cette étude, démontrant la possibilité de réguler spécifiquement certaines voies de transport intracellulaire, ouvre des nouvelles pistes de recherche thérapeutique basées sur la biologie cellulaire et pourrait permettre d'explorer de nouveaux moyens de lutter contre de nombreuses pathologies.
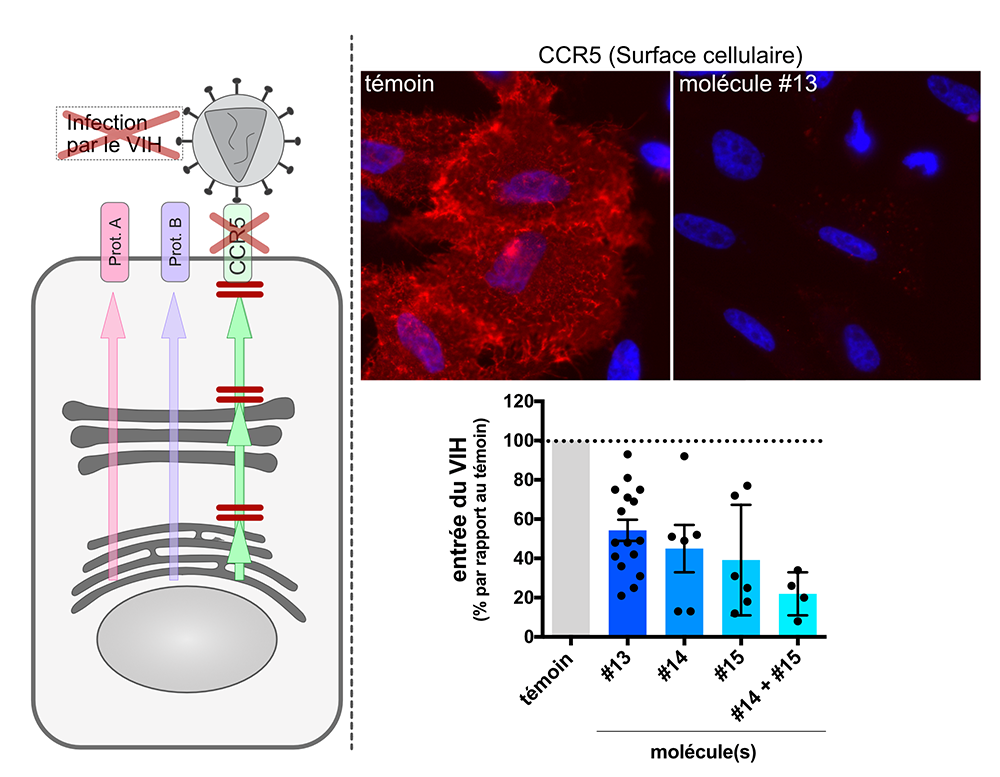
Figure : Différentes voies de transport existent dans les cellules et il est possible de perturber le transport d’une classe de protéines sans perturber le transport d’autres classes (Schéma de gauche). Nous avons cherché à inhiber le transport de la protéine CCR5 qui permet l’entrée dans les cellules du VIH, l’agent du SIDA. Des composés chimiques comme la molécule #13 réduisent fortement le transport de CCR5 (en rouge, Figure en haut à droite) dans un système modèle (cellules HeLa). Cette molécule ainsi que d’autres identifiées dans cette étude réduisent fortement l’infection de macrophages humains par le VIH (histogramme en bas à droite).
Pour en savoir plus :
Targeting CCR5 trafficking to inhibit HIV-1 infection
Boncompain G, Herit F, Tessier S, Lescure A, Del Nery E, Gestraud P, Staropoli I, Fukata Y, Fukata M, Brelot A, Niedergang F, Perez F.
Science Advances, 16 Octobre 2019. DOI : 10.1126/sciadv.aax0821
Transport de CCR5
Le transport de CCR5 fluorescent a été synchronisé grâce au système RUSH développé par le laboratoire. Ceci permet de suivre et quantifier le transport de CCR5 vers la surface cellulaire en temps réel par microscopie confocale. (Film de droite). Ce transport est fortement réduit lorsque les cellules sont traitées par la molécule #13 (Film de gauche).