Les signaux épigénétiques : comment les marques de l’ADN façonnent le plan de la vie
Dans chacune de nos cellules des modifications, dites épigénétiques, permettent l’expression ou la répression de leur répertoire de gènes. Dans un article publié dans Nature Structural and Molecular Biology, des scientifiques ont démontré comment deux mécanismes qui individuellement agissent pour réprimer l’action de certains gènes, peuvent en se combinant provoquer l’effet contraire. Ils ont également montré que ce phénomène se produit sur de nombreux gènes.
Nous commençons notre vie en tant que cellule unique. Celle-ci s'est divisée en milliards de cellules qui ont acquis des emplois spécifiques, tels que la communication dans le cerveau et la contraction dans les muscles. Cependant, la séquence d’ADN reste identique dans chacune de nos cellules. Comment les cellules, qui contiennent toutes la même séquence d'ADN, accomplissent-elles des tâches aussi variées ?
Jusqu'à présent, nous avons compris que les cellules spécialisées (comme les cellules du cerveau et des muscles) diffèrent les unes des autres en fonction des gènes qu'elles expriment. En d'autres termes, si toutes les cellules contiennent les mêmes gènes, seule une fraction de ces gènes est "activée" dans un type de cellule donné. La recherche sur l'«épi»génétique a montré que l'ADN et les protéines autour desquelles il est enroulé sont décorés de modifications qui déterminent si un gène est activé ou non, et ce sans changer la séquence d'ADN elle-même. Non seulement l'épigénétique est importante pour transformer une simple cellule en un organisme avec des tâches complexes, mais dans les cellules cancéreuses, l'épigénome est déréglé.
Utilisation de cellules souches pour modéliser la reprogrammation épigénétique
Dans un article publié dans Nature Structural and Molecular Biology, les scientifiques ont simulé le les premières étapes du développement embryonnaire chez la souris en laboratoire afin d'étudier l'effet de l'établissement de modifications épigénétiques dans l'embryon. Ils ont découvert que deux modifications épigénétiques qui individuellement réprime l’activation d’un gène peuvent se rencontrer et s'annuler l'une l'autre, conférant ainsi, de manière non intuitive, l'activation d'un gène. Ils ont trouvé de nombreux gènes affectés par ce processus.
La manipulation de l'épigénome pour démontrer la fonction de la méthylation de l'ADN
De plus, ils ont utilisé diverses techniques de pointe, notamment l'édition de l'épigénome en utilisant un système CRISPR/Cas9 pour modifier précisément les marques de méthylation de l'ADN à des gènes d'intérêt . Ces outils leur ont permis de valider leurs résultats, qui contribuent à expliquer comment certains gènes sont naturellement activés au cours du développement. Il est intéressant de noter que les modifications épigénétiques établies au cours du développement sont héritées à l'âge adulte, fournissant des informations sur l'activation ou la désactivation des gènes tout au long de la vie. Dans l'ensemble, cette recherche approfondit notre compréhension de l'interaction entre deux mécanismes responsables de la désactivation des gènes, avec des implications importantes pour plusieurs cancers où ces deux voies sont dérégulées.
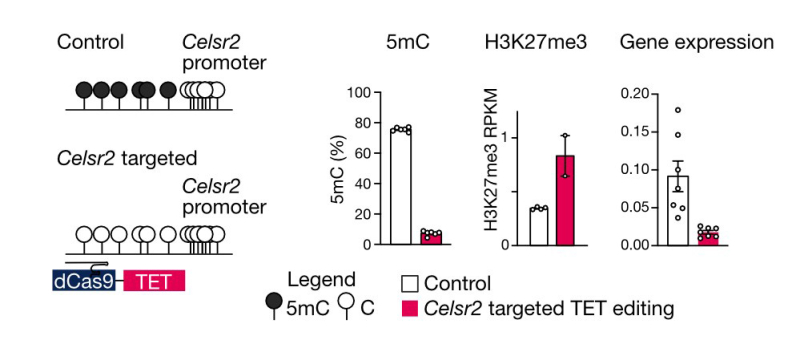
Figure : Schéma de l'effacement ciblé de la méthylation de l'ADN (5mC) au locus du gène Celsr2. La déméthylation est réalisée par l'activité de l'enzyme TET (rouge), ciblée par le système dCas9-gRNA. Après ciblage, les résultats montrent une déméthylation (de 5mC à C), un enrichissement pour la marque répressive (H3K27me3) et une répression importante du gène.
En savoir plus : Richard Albert, J., Urli, T., Monteagudo-Sánchez, A. et al. DNA methylation shapes the Polycomb landscape during the exit from naive pluripotency. Nat Struct Mol Biol (2024). https://doi.org/10.1038/s41594-024-01405-4
Contact
Laboratoire
Institut Jacques Monod - IJM (CNRS/Université Paris Cité)
15 rue Helene Brion
F-75205 Paris Cedex 13, France
