Les secrets du mouvement du parasite Toxoplasma gondii dévoilés
Dans un article publié dans Nature Microbiology, des scientifiques ont décrypté la stratégie de glissement rapide du microbe parasite Toxoplasma gondii au sein des tissus de l’organisme hôte. Ils montrent comment le parasite arrive à s’accrocher suffisamment sans risquer de rester coller à son substrat afin de glisser efficacement. En expliquant comment un système minimal d’adhésion est capable de générer un mouvement rapide au sein de microenvironnements complexes ils ouvrent des perspectives pour d’autres modèles d’interactions cellulaires.
Toxoplasma gondii : l’agent de la toxoplasmose
Le microbe parasite Toxoplasma gondii (T.gondii) appartient au phylum des Apicomplexes composé de plus de 6000 espèces parasites identifiés à ce jour. Il se distingue par son cosmopolitisme et sa capacité à parasiter et à persister chez tous les animaux à sang chaud, y compris l’homme. T. gondii est l’agent causal de la toxoplasmose, une maladie souvent bénigne lors de la primo-infection hormis pour le foetus, mais qui peut conduire sous sa forme chronique, à des encéphalites, des myocardites sévères et des atteintes systémiques si elles ne sont pas contrôlées par une thérapie lourde. Après ingestion de formes contaminantes par l’hôte, le parasite se différencie sous un morphotype appelé tachyzoïte qui prolifère au sein des cellules de la muqueuse intestinale (au niveau du petit intestin) où il est généralement rapidement contrôlé par le système immunitaire. Cependant, une fraction de la population de tachyzoïtes échappe au contrôle et dissémine dans les tissus profonds comme le cerveau, le système nerveux périphérique (œil) et les muscles squelettiques avant de s’enkyster quasi incognito sous un stade de développement qui ne se réplique presque plus, le bradyzoïte . C’est au cours d’un dysfonctionnement du système immunitaire transitoire ou prolongé que le bradyzoite réverte en tachyzoïte. Ce dernier prolifère en l’absence de contrôle immunitaire compétent, causant la destruction massive des cellules hôtes et en conséquence, des dommages tissulaires irréversibles.
Les mécanismes de son déplacement rapide dans les tissus encore mal compris
Le tachyzoïte sert de prototype chez les Apicomplexes pour étudier les propriétés mobiles dans les matrices extracellulaires et invasives dans les cellules car il se déplace à des vitesses supérieures à plusieurs microns par seconde et pénètre les cellules-hôtes en quelques secondes. Ces activités qui sont obligatoires pour la pérennité du toxoplasme procèdent selon des mécanismes qui ne sont pas encore totalement élucidés. Dans un article publié dans la revue Nature Microbiology, les scientifiques ont cherché à comprendre comment le tachyzoïte de T.gondii. s’adapte aux contraintes mécaniques fluctuantes auxquelles il est confronté dans les différents tissus et cellules de son hôte. En s’inscrivant à l’interface parasitologie-biologie cellulaire, biophysique et chimie de surface, ces travaux ont permis une avancée originale dans la compréhension du couplage dynamique entre les points de contact du parasite au substrat sur lequel ce dernier se déplace, et la transmission d’une force de traction, rendant ainsi compte des propriétés motiles et invasives exceptionnelles de ce parasite.
Mécanismes moléculaires du glissement dévoilés : s’accrocher suffisamment tout en glissant efficacement
Le tachyzoïte est une cellule arquée de quelques micromètres de long avec une architecture polarisée apico-basale marquée. C’est le pôle apical qui instruit la direction du mouvement et la trajectoire hélicoïdale typique du parasite. En effet, au sein du pôle apical, sont regroupés plusieurs organelles à fonction sécrétoire dont les produits de type « adhésines » sont essentiels pour promouvoir l’activité mobile et invasive du parasite ainsi qu’un centre nucléateur d’actine jouant le rôle d’allumage du système moteur du parasite. C’est le flux apicobasal de filaments d’actine tirés par des myosines sous- membranaires et disposées sur la longueur du parasite qui entraine les adhésines vers l’arrière du parasite et lui permet de glisser vers l’avant. L’une des inconnues concerne les modalités de l’engagement moléculaire des adhésines sécrétées au pôle apical avec des molécules de la matrice extracellulaire pour assembler des points d’ancrages sur le substrat efficaces pour transmettre une force de traction. En d’autres termes, comment s’accrocher suffisamment mais pas trop pour pouvoir glisser sans risquer de se détacher ou de rester « collé » au substrat ?
Une collaboration entre biophysiciens et des chimistes moléculaires, a permis aux scientifiques de développer une approche combinatoire inédite afin de tester les requis minimaux en termes d’adhésion au substrat pour que le parasite glisse efficacement. Ces travaux identifient un point d’ancrage singulier initié entre l’apex du parasite et le substrat sur lequel le parasite avance. L’utilisation de différentes microscopies ultra-rapides couplées au matriçage de surfaces micrométriques pro-adhésive et anti-adhésive alternées a révélé que ce point de contact est suffisant pour une performance optimale du parasite. C’est aussi l’introduction de la chimie de surface avec la mesure instantanée des interactions entre molécules greffées sur des systèmes de surface anti-adhésive qui a permis de cribler, à l’échelle de l’espèce moléculaire isolée, les ligands les plus simples capables d’interagir avec les adhésines pour assembler un point d’ancrage fonctionnel. Combinées à l’analyse des propriétés visco-élastiques des surfaces synthétiques proposées au parasite et au suivi en temps réel des capacités mobiles de ce dernier, ces essais ont permis de démontrer que les sulfates d’héparane, sucres sulfatés abondants dans matrices extracellulaire et sur les cellules, interagissent avec les adhésines du parasite pour former une plateforme de transmission efficace d’une force de traction lors du glissement. Ces approches expérimentales complémentaires ont révélé depuis l’échelle moléculaire jusqu’à celle du microorganisme, comment ce microbe dose a minima les interactions entre les adhésines exposées en surface et les espèces moléculaires du microenvironnement (en 2D) mais également avec son système moteur.
Au-delà de l’étude de T. gondii, ces résultats ouvrent des perspectives théoriques et appliquées pour la compréhension d’un système minimal d’adhésion capable de générer un déplacement au sein de microenvironnements complexes.
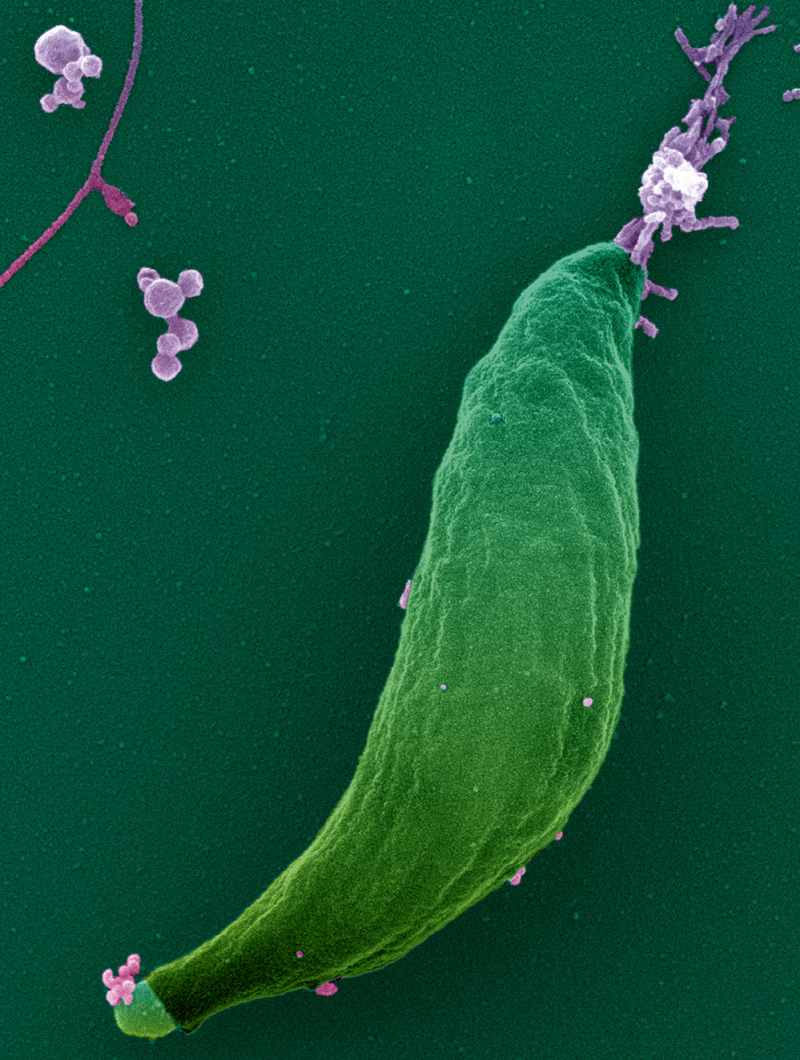
Figure : Le stade tachyzoïte du parasite Toxoplasma gondii mesure quelques micromètres de long (pseudocouleur verte). Il se caractérise par son pôle apical conique et effilée à partir duquel sont sécrétées des vésicules appelées micronèmes (pseudocouleur rose) lorsque le parasite est prêt à se déplacer. Les adhésines contenues dans les micronèmes restent exposées à la surface. Le toxoplasme glisse dans les matrices extracellulaires par un mouvement hélicoïdal sous le contrôle d’un flux apicobasal de la membrane plasmique dirigé par un système moteur. Le matériel membranaire, y compris les adhésines, s’accumule alors à l’extrémité basale du parasite et forme des segments rectilignes quand le parasite s’étire pour continuer de glisser.
Référence : Submicrometre spatiotemporal characterization of the Toxoplasma adhesion strategy for gliding motility | Nature Microbiology. Luis Vigetti, Bastien Touquet, Lionel Bureau, Dima Abdallah, Isabelle Tardieux , Delphine Debarre, Thierry Rose, Galina V. Dubacheva.
Nature Microbiology, 4 novembre 2024,
Contact
Laboratoires
Institut pour l'avancée des biosciences - IAB (CNRS/Inserm/Université Grenoble Alpes)
UNIV GRENOBLE ALPES
Bât Albert BONNIOT
Site Santé Allée des Alpes
38700 LA TRONCHE - France
Département de Chimie Moléculaire - DCM (CNRS/Université Grenoble Alpes)
UNIV GRENOBLE ALPES
DCM
301 et 570 rue de la chimie
38058 GRENOBLE CEDEX 9 - France
