Les secrets de l’assemblage du « bon » collagène dévoilés
Les équipes de Catherine Moali au laboratoire Biologie tissulaire et ingénierie thérapeutique et de Nushin Aghajari au laboratoire Microbiologie moléculaire et biochimie structurale explicitent le mécanisme d’assemblage de la « bonne » forme de la protéine la plus abondante chez l’homme, le collagène de type I. Cette étude a été publiée le 10 mars 2017 dans la revue Nature Communications.
Les collagènes constituent environ 30% de la masse totale de toutes les protéines du corps humain. Alors qu’il existe 28 types de collagène différents chez l’homme, le collagène de type I est de loin la forme la plus répandue (90 % du total). La molécule de collagène I a la forme d’un bâtonnet 200 fois plus long que large. A l’extérieur des cellules, au sein de la « matrice extracellulaire », ces molécules s’associent spontanément entre elles afin de former des fibres de plusieurs millimètres de longueur. Ces fibres jouent un rôle primordial dans la plupart des tissus et organes tels que la peau, les os, le cartilage, les tendons, la cornée, les vaisseaux et le cœur. Ainsi, elles créent la charpente à la base de l’organisation tridimensionnelle de systèmes multicellulaires. En plus de ce rôle essentiellement structural, le collagène I est également impliqué dans plusieurs autres phénomènes (transparence de la cornée, migration et prolifération cellulaire, etc) ainsi que dans de nombreuses maladies héréditaires et acquises.
Chaque molécule de collagène I comporte trois chaînes polypeptidiques, chacune constituée d’environ 1000 acides aminés. Normalement, deux de ces chaines sont génétiquement identiques (appelées α1) tandis que la troisième chaîne est distincte (appelée α2). Cette « bonne » forme de collagène I est appelée hétérotrimère. Cependant, dans les tissus embryonnaires ainsi que dans certaines maladies telles que le cancer, la fibrose, l’arthrose, l’ostéoporose et l’ostéogenèse imparfaite, on trouve également une « mauvaise » forme de collagène I, appelée homotrimère, constituée de trois chaines α1 identiques. Bien que l’homotrimère conserve la capacité de s’associer en fibres, celles-ci ont des caractéristiques différentes de celles de l’hétérotrimère, aboutissant ainsi à des maladies souvent graves. Néanmoins, malgré un siècle de recherche, les mécanismes qui déterminent l’assemblage de ces différentes formes du collagène I restaient inconnus.
Afin d’éviter la formation prématurée des fibres à l’intérieur de la cellule, ces collagènes sont synthétisés sous la forme de précurseurs solubles, les procollagènes, composés d’une longue partie centrale en forme de bâtonnet flanquée de deux régions globulaires (appelés N-propeptides et C-propeptides). Ce sont les C-propeptides qui assurent l’association précise des chaînes α1 et α2.
Pour la première fois, les chercheurs ont déterminé la structure tridimensionnelle de l’homotrimère des C-propeptides du procollagène I, ce qui révèle la nature exacte des mécanismes de reconnaissance impliqués. Ils ont également étudié les effets de plusieurs mutations ponctuelles qui gouvernent l’assemblage de l’homotrimère et de l’hétérotrimère. Ces expériences démontrent qu’une seule mutation dans la chaine α1 (identifiée précédemment chez un patient souffrant d’ostéogénèse imparfaite) empêche l’incorporation de la chaine α2 dans l’hétérotrimère. Enfin, par modélisation moléculaire, quatre acides aminés présents sur la chaîne α2 (qui est incapable de s’associer avec elle-même) ont été identifiés comme essentiels pour la formation de l’hétérotrimère. Ces résultats permettront de mieux comprendre l’organisation de nombreux tissus et organes avec des retombées éventuelles pour la santé humaine.
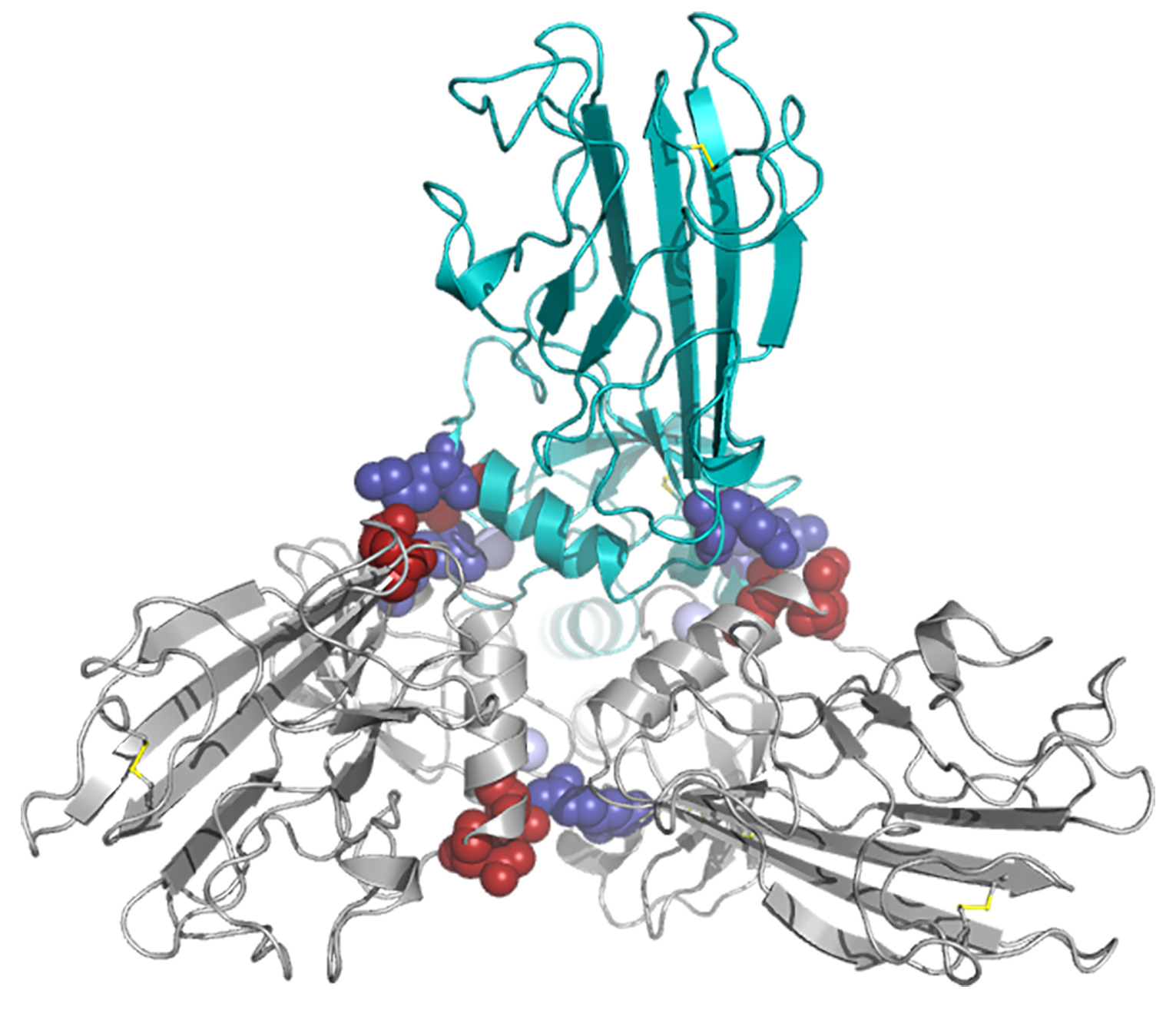
Figure 1: Modèle tridimensionnel de l’hétérotrimère des C-propeptides du procollagène de type I. Vue de l’extrémité C-terminale de la molécule orientée de façon perpendiculaire au plan de la page. Les deux chaînes α1 sont en gris et la chaîne α2 en bleu/vert. Les acides aminés clé dans chaque interface sont indiqués en rouge (chargés négativement) et bleu (chargés positivement).
© David Hulmes.
En savoir plus
-
Structural basis of homo- and heterotrimerization of collagen I.
Sharma U, Carrique L, Vadon-Le Goff S, Mariano N, Georges RN, Delolme F, Koivunen P, Myllyharju J, Moali C, Aghajari N, Hulmes DJ.
Nat Commun. 2017 Mar 10;8:14671. doi: 10.1038/ncomms14671