Les nanotechnologies à la rescousse pour analyser le virus SARS-CoV-2 natif et inactivé
Comment inactiver le SARS-CoV-2 par des fixateurs chimiques sans altérer sa structure ? Pour répondre à cette question, les scientifiques ont analysé à haute résolution la morphologie des particules du SARS-CoV-2 après différents traitements chimiques au moyen d’un Microscope à Force Atomique unique en Europe. Ces travaux, publiés dans la revue Nature Scientific Reports, montrent que les nanotechnologies recèlent un énorme potentiel dans la lutte contre les virus pathogènes.
Le SARS-CoV-2 est un virus classé dans le groupe des pathogènes de classe 3 et doit donc être étudié dans un laboratoire confiné de niveau de sécurité biologique 3 (NSB3). L'inactivation des particules virales par des méthodes physiques (chaleur, radiations) ou chimiques (alcool, peroxyde, fixateurs, détergents) est alors requise pour transférer les échantillons de virus du laboratoire NSB3 vers un laboratoire de niveau de sécurité inférieur, afin d'accélérer les recherches contre la pandémie COVID19. Les scientifiques se sont ainsi concentrés sur l'inactivation du SARS-CoV-2 dans le but de générer des particules virales inactivées, non infectieuses, mais structuralement intactes, ce qui est nécessaire pour de nombreuses applications biomédicales. Afin de vérifier l'état morphologique des virions selon les différents traitements chimiques utilisés, les particules du SARS-CoV-2 ont été analysées à haute résolution (de l’ordre du nanomètre) au moyen d'un Microscope à Force Atomique (AFM), spécialement modifié pour fonctionner dans le laboratoire NSB3 du CEMIPAI.
L’AFM est l’instrument phare des nanotechnologies. Il permet d’analyser des objets biologiques déposées sur une surface grâce un balayage par une sonde. Cette dernière est constituée d’une pointe très fine, placée à l’extrémité d’un minuscule levier. L’enregistrement de la déviation du levier, à l’aide d’un laser, permet de déterminer le déplacement vertical de la pointe, pour générer une image topographique et mesurer les forces d’interaction entre la pointe et l’échantillon.
Cette technique d'imagerie unique, complémentaire de la microscopie électronique, permet de visualiser rapidement des virus dans leur environnement liquide natif, à l'échelle du nanomètre, sans colorer ou fixer l'échantillon. Les scientifiques ont déposé des virus SARS-CoV-2 infectieux sur une surface de mica et ont ainsi pu déterminer directement l’effet de la chaleur ou de fixateurs chimiques (formaldéhyde) sur la morphologie des particules virales. En parallèle, ils ont vérifié leur infectiosité en culture cellulaire. Un protocole très simple a ainsi pu être mis en place pour rapidement inactiver les particules de SARS-CoV-2 tout en conservant leur forme sphérique, pour une utilisation sûre des échantillons en laboratoire NSB2. L’AFM apparaît alors comme une microscopie particulièrement adaptée à l’analyse rapide et directe de l’effet d’agents physiques ou chimiques sur les virus pathogènes, et permet ainsi de proposer des stratégies nouvelles pour lutter contre les maladies infectieuses.
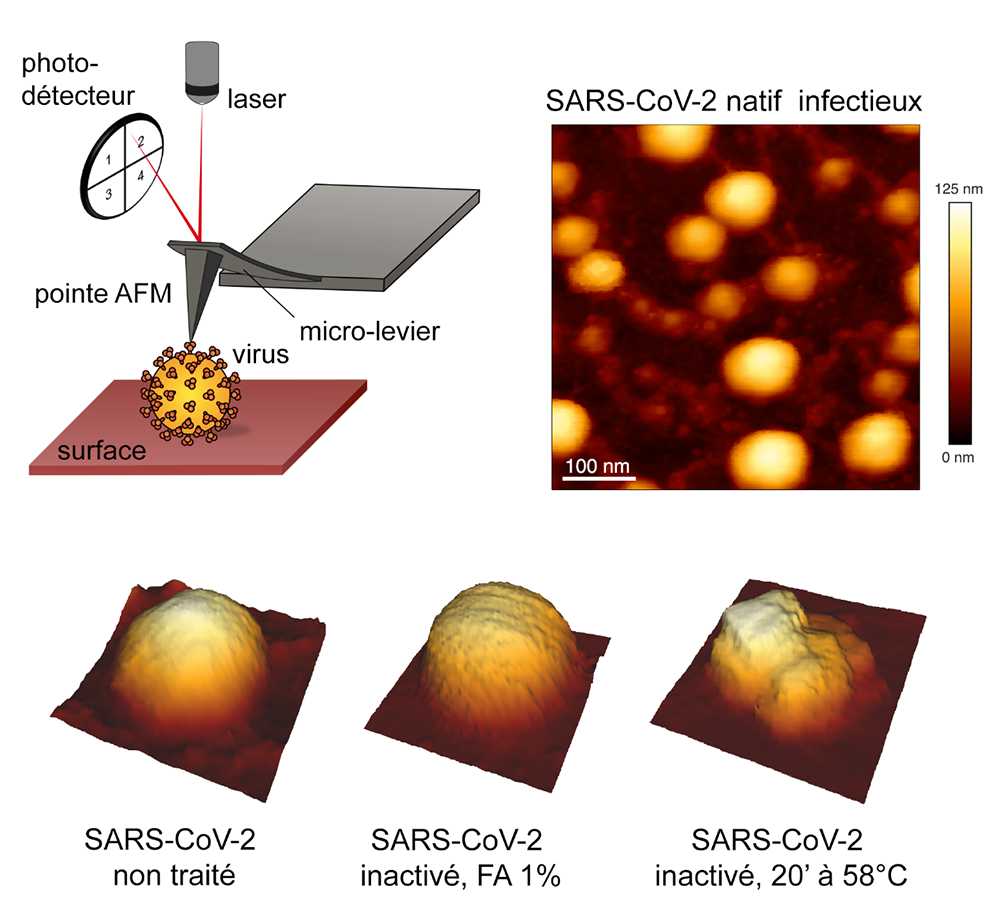
Figure. En haut à gauche, principe du microscope AFM où l’échantillon est scanné par une pointe ultrafine au bout d’un micro-levier, dont les variations d’amplitude sont détectées par un système laser et un photodétecteur. Images : virions purifiés du SARS-CoV-2 infectieux, déposés sur une surface de mica et imagés au microscope AFM en milieu liquide. L’échelle en dégradé de couleurs correspond à la hauteur des particules virales. Dans l’image en haut à droite, les virus apparaissent connectés en réseau. Les images de la ligne inférieure représentent des vues 3D de particules virales reconstituées à partir des informations topographiques enregistrées par le microscope AFM ; de gauche à droite : SARS-CoV-2 natif non traité, SARS-CoV-2 inactivé par 1% de Formaldéhyde (FA) et SARS-CoV-2 détruit par une incubation de 20 minutes à 58°C.
Pour en savoir plus :
Atomic force microscopy analysis of native infectious and inactivated SARS-CoV-2 virions.
Lyonnais S, Hénaut M, Neyret A, Merida P, Cazevieille C, Gros N, Chable-Bessia C, Muriaux D.
Sci Rep. 2021 Jun 4;11(1):11885. doi: 10.1038/s41598-021-91371-4.
Contact
Laboratoire
Centre d’étude des maladies infectieuses et pharmacologie anti-infectieuses CEMIPAI (CNRS / Université de Montpellier)
1919 Route de Mende
34293 Montpellier cedex 5
Institut de Recherche en Infectiologie de Montpellier (IRIM)
UMR 9004 - CNRS / UM
1919 route de Mende
34293 Montpellier cedex 5
Institut de Neuroscience de Montpellier (INM)
CHU Montpellier Saint Eloi
80 Avenue Augustin Fliche
34091 Montpellier cedex 5 France
