Les hormones thyroïdiennes au cœur de l’intégration des saisons par le cerveau
Les fonctions biologiques saisonnières sont synchronisées avec l’environnement par les variations photopériodiques de la sécrétion nocturne de mélatonine. Cependant, les mécanismes impliqués dans l’intégration de ce message ne sont pas encore bien caractérisés. L’étude, publiée dans la revue FASEB journal, démontre que la mélatonine agit via des récepteurs TRα aux hormones thyroïdiennes pour réguler l’expression du RFRP3, un neuropeptide essentiel pour synchroniser la reproduction saisonnière.
La mélatonine est un calendrier hormonal qui permet aux mammifères d’adapter leurs fonctions biologiques aux cycles des saisons. Ainsi l’allongement de la production nocturne de mélatonine par la glande pinéale informe l’organisme de l’arrivée de l’hiver, tandis que sa réduction informe de l’arrivée de l’été. A partir des années 1960, des expériences de lésion de la glande pinéale ou d’administration de mélatonine exogène ont démontré que ces changements annuels de la production de mélatonine synchronisent de nombreuses fonctions biologiques avec les saisons, notamment la reproduction, l’activité métabolique, le système immunitaire, l’hibernation, etc. La découverte des récepteurs de la mélatonine a ensuite aidé à comprendre les mécanismes d’action de cette hormone. Ainsi la mélatonine se fixe sur la pars tuberalis de l’hypophyse pour réguler la synthèse de thyrotropine qui agit ensuite sur les tanycytes, des cellules gliales de l’hypothalamus, pour convertir la thyroxine (T4) en triiodothyronine bioactive (T3). Même s’il est maintenant établi que les modifications intra-hypothalamique de T3 synchronisent les fonctions reproductrices et métaboliques avec les saisons, les sites d’action de la T3 sont inconnues.
Les scientifiques ont utilisé différents modèles de souris génétiquement modifiées pour le récepteur Tra afin d’identifier les types cellulaires régulés par les variations saisonnières de T3. Ils ont particulièrement examiné la réponse d’une population de neurones hypothalamiques produisant le neuropeptide RFRP3, considéré comme un élément central de la régulation de la reproduction saisonnière. Ils ont observé que la mutation globale de Tra supprime l’effet inhibiteur de la mélatonine sur l’expression du RFRP3 alors que si la mutation de Tra est restreinte aux neurones, la mélatonine conserve sa capacité à réguler les neurones à RFRP3. Conformément à ces observations, les auteurs ont ensuite montré que les TRα sont principalement localisés sur les tanycytes, et non dans les neurones à RFRP3. Ainsi, ce travail établit que les hormones thyroïdiennes produites dans l’hypothalamus sous le contrôle de la mélatonine régulent la synthèse de RFRP3 par une action non neuronale, possiblement tanycytaire, via leurs récepteurs TRα.
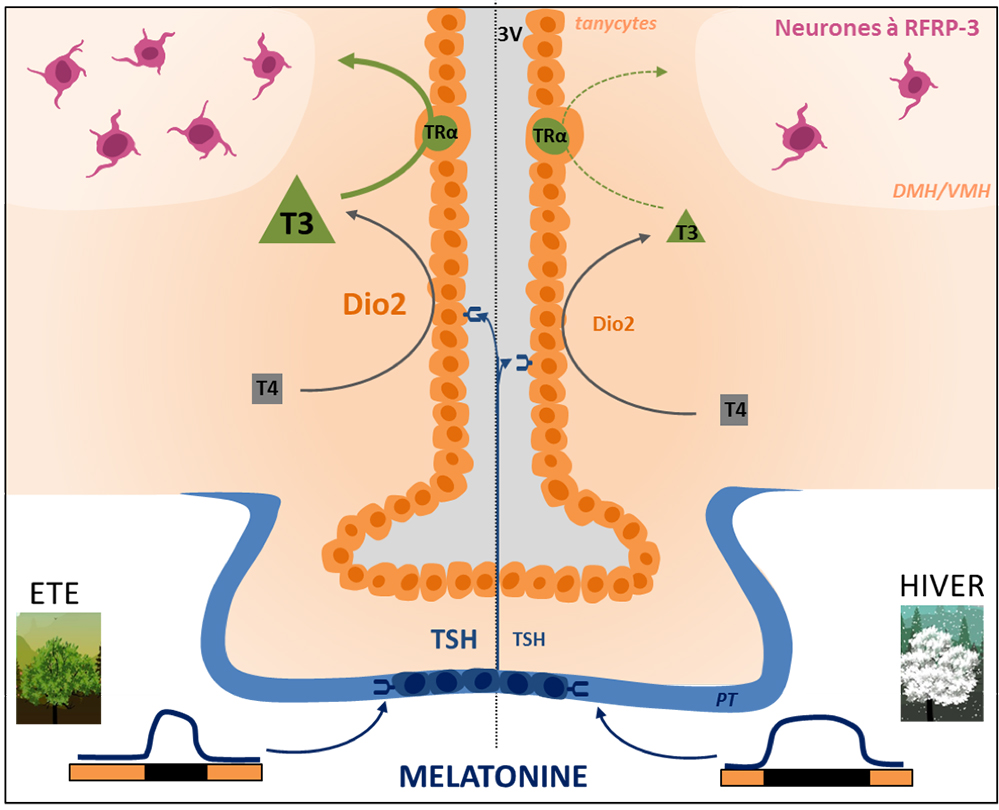
Figure : Modèle hypothétique de la régulation mélatonine-dépendante de RFRP-3 dans l’hypothalamus par les récepteurs TRα tanycytaires. Le signal photopériodique véhiculé par la mélatonine est détecté par les récepteurs à la mélatonine situés sur les cellules thyréotropes de la pars tuberalis (PT) et régule la production de thyréostimuline (TSH). En photopériode longue (été), la forte production de TSH en réponse au pic court de mélatonine nocturne active ses récepteurs localisés sur les tanycytes, des cellules épendymales tapissant la paroi du 3ème ventricule (3V), résultant en une augmentation de l’expression de la diodinase 2 (Dio2). Dio2 convertit la T4 en T3, la forme active des hormones thyroïdiennes et régule ainsi les concentrations de cette dernière dans l’hypothalamus médiobasal. Il est proposé que la T3 locale régule les neurones à (Ard)-(Phe)-related-peptide-3 (RFRP-3) de l’hypothalamus doso- et ventro-médian (DMH/VMH) par le biais de récepteurs TRα tanycytaires, avec une diminution notable du nombre de ces neurones en photopériode courte (hiver) lorsque l’activité T3-TRα est faible.
Pour en savoir plus:
Thyroid hormone receptors are required for melatonin-dependent control of Rfrp gene expression in mice.
Quignon C, Beymer M, Gauthier K, Gauer F, Simonneaux V
The FASEB journal, 10 August 2020 . https://doi.org/10.1096/fj.202000961R
Contact
Laboratoire
Institut des Neurosciences Cellulaires et Intégratives (INCI) - (CNRS)
8, allée du Général Rouvillois, 67000 Strasbourg