Les cellules se relaxent pour orienter leur division
Ce travail sur un invertébré marin publié dans la revue Developmental Cell révèle un assouplissement des cellules embryonnaires avant de se diviser. C’est un résultat surprenant puisque les cellules animales entrant en division sont habituellement rigides. Avec des approches couplant biophysique et simulations numériques, les chercheurs ont démontré un rôle de cette relaxation cellulaire dans l’orientation des divisions. Un mécanisme simple et robuste qui pourrait exister chez d’autres espèces.
Lorsqu’une cellule animale se prépare à se diviser, elle entre dans une phase du cycle cellulaire spécifique appelée mitose, où elle opère généralement un changement morphologique drastique pour devenir arrondie. Des études réalisées sur des cellules isolées en culture ont démontré que cet arrondissement mitotique est réalisé par une augmentation de la rigidité cellulaire. Ces résultats ont été extrapolés aux contextes multicellulaires in vivo, où la cellule en mitose devenue rigide résiste aux perturbations mécaniques externes qui pourraient perturber ce processus fondamental.
Un récent travail de recherche a utilisé l’ascidie Phallusia mammillata comme organisme modèle dans le but d’étudier le mécanisme d’arrondissement mitotique dans un contexte multicellulaire in vivo. L’embryon de cet invertébré marin possédait deux qualités importantes pour ce projet : il se développe avec un petit nombre de cellules et présente un décalage dans le timing du cycle cellulaire entre les deux pôles de l’embryon.
Les chercheurs ont directement mesuré la rigidité des cellules et ont observé que celles-ci s’assouplissent systématiquement lorsqu’elles entrent en mitose. Ce processus est même profondément inscrit dans ces cellules, puisqu’elles le font aussi lorsqu’elles sont isolées de leurs voisines. Cet assouplissement est accompli par la réduction de l’activité d’un moteur moléculaire, la protéine myosine, la même qui permet la contraction de nos fibres musculaires.
Quelle peut être la fonction de cet assouplissement cellulaire en mitose ? Pour répondre à cette question, les chercheurs ont dans un premier temps combiné l’usage de simulations numériques et d’expériences biophysiques pour montrer que les cellules mitotiques d’un pôle de l’embryon sont déformées par les cellules non-mitotiques situées à l’autre pôle, qui littéralement les étirent. Ensuite, la manipulation des forces présentes dans l’embryon par des techniques de micro-injection ou de micro-dissection ont prouvé que cette déformation des cellules mitotiques par les forces mécaniques éloignées contrôle in fine l’orientation de la division cellulaire.
L’orientation des divisions cellulaires par les forces mécaniques externes est un processus courant au sein d’embryons ou de tissus cellulaires. En revanche, les mécanismes connus jusqu’alors étaient très différents et plus complexes que celui découvert chez l’embryon d’ascidie qui apparaît plus simple et plus direct. D’ailleurs, certaines indications dans la littérature scientifique suggèrent que ce mécanisme pourrait exister chez d’autres espèces, d’autant plus qu’il apparait comme étant extrêmement robuste. En effet, l’assouplissement des cellules mitotiques est ainsi à la base du patron de divisions cellulaires prédéterminées qui existent chez toutes les ascidies depuis plus de 400 millions d’années.
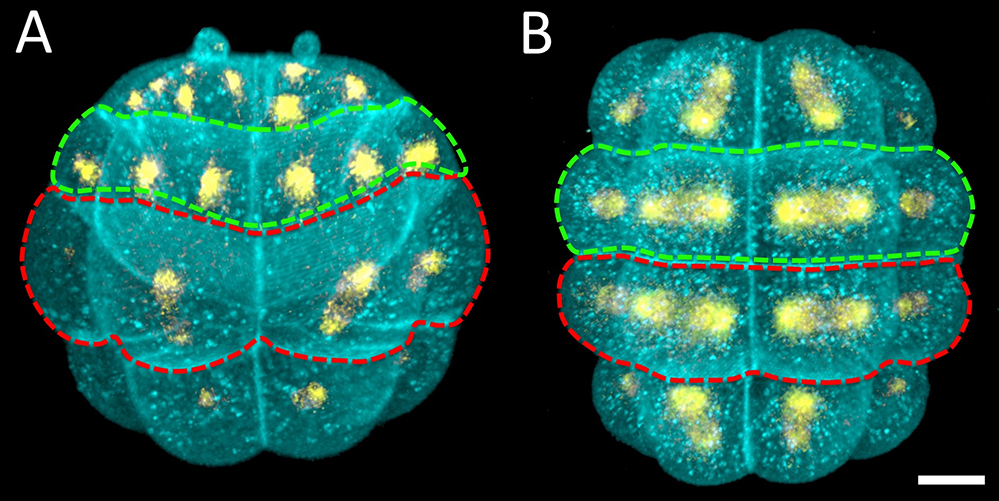
Figure : Les cellules mitotiques se déforment selon les forces externes.
Images en microscopie fluorescente d’embryon de Phallusia mammillata avec les cellules marquées en bleu et les centrosomes (indiquant l’orientation de la prochaine division) en jaune.
A) Les deux pôles de l’embryon sont asynchrones générant des forces inégales dans l’embryon. Les cellules mitotiques (entourées en rouge) sont étirées par les cellules non-mitotiques (entourées en vert).
B) Les deux pôles de l’embryon sont synchrones, les forces sont égales dans l’embryon. Toutes les cellules sont en mitose (entourées en rouge et vert) et ne présentent pas de déformation vers un pôle de l’embryon.
Barre d’échelle : 20 µm
Pour en savoir plus :
Apical Relaxation during Mitotic Rounding Promotes Tension-Oriented Cell Division.
Godard BG, Dumollard R, Munro E, Chenevert J, Hébras C, McDougall A, Heisenberg CP.
Developmental Cell. 17 Nov 2020. https://doi.org/10.1016/j.devcel.2020.10.016
Contact
Laboratoire
Laboratoire de biologie du développement de Villefranche-sur-Mer (LBDV) - (Sorbonne Université, CNRS)
Institut de la Mer de Villefranche-sur-Mer
181 Chemin du Lazaret, 06230, Villefranche-sur-Mer