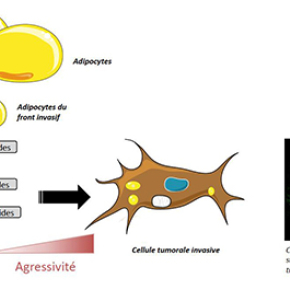
Les cellules graisseuses situées à proximité des cancers du sein nourrissent les cellules tumorales et favorisent leur agressivité
Des chercheurs de l’Institut de pharmacologie et de biologie structurale ont mis en évidence que les cellules graisseuses, ou adipocytes, très nombreuses dans le sein, favorisent la dissémination des cellules cancéreuses en leur fournissant des lipides. Les cellules tumorales stockent ces lipides et les libèrent au cours du temps ce qui leur permet de maintenir leur caractère agressif après leur contact initial avec les adipocytes. Ces résultats ont été publiés le 23 février 2017 dans la revue JCI Insight.
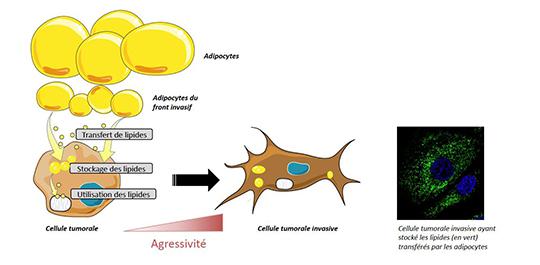
Le cancer du sein est le cancer féminin le plus fréquent. Malgré les avancées dans la caractérisation et le traitement de cette maladie, elle reste une cause majeure de décès dans le monde. La principale origine de ces décès est l’existence de métastases liées à la capacité des cellules tumorales à se disséminer d’abord localement puis à distance dans d’autres organes. Les cellules graisseuses, ou adipocytes, sont très présentes à coté des cancers du sein et les chercheurs avaient mis en lumière auparavant un dialogue étroit, sur le front invasif des cancers (c’est-à-dire là où la tumeur rencontre le tissu graisseux) entre les adipocytes et les cellules cancéreuses mammaires, au profit du développement du cancer (Dirat et al. Cancer Research, 2011 ; Bochet et al. Cancer Research 2013). Les adipocytes à proximité de la tumeur présentent une diminution de leur taille et de leur contenu en lipides. Les scientifiques ont donc cherché à savoir si les lipides libérés par les adipocytes pouvaient être captés et utilisés par les cellules cancéreuses.
En utilisant un système de co-culture, les chercheurs ont montré qu’en présence de cellules cancéreuses, les adipocytes libèrent des lipides (acides gras) qui sont ensuite captés et, pour ceux en excès, stockés sous la forme de gouttelettes lipidiques dans les cellules tumorales. Ces résultats ont été confirmés au front invasif des tumeurs dans des échantillons de patientes avec un cancer du sein. Cet apport d’acides gras dans les cellules cancéreuses modifie leur métabolisme qui va alors reposer sur cette nouvelle source énergétique et favoriser leurs capacités invasives. L’inhibition pharmacologique et génique de ce remodelage métabolique (inhibition du transfert des acides gras vers les mitochondries où ils seront utilisés) réduit les capacités invasives des cellules tumorales préalablement co-cultivées avec des adipocytes in vitro mais aussi le nombre et la taille des métastases pulmonaires in vivo chez la souris.
Les chercheurs ont ensuite étudié si les cellules tumorales avaient la capacité de libérer au cours du temps les lipides stockés en excès sous la forme de gouttelettes contenant des triglycérides (polymères d’acides gras). Cette activité permettrait aux cellules cancéreuses de bénéficier d’une source d’énergie alors qu’elles ne sont plus en contact direct avec les adipocytes et qu’elles ont quitté la tumeur pour entrer dans la circulation et rejoindre le site métastatique. Les chercheurs ont montré l’existence d’une activité de libération des triglycérides dans les cellules tumorales reposant sur l’activité d’une enzyme appelée ATGL (Adipose TriGlyceride Lipase) dont l’expression n’avait pas été décrite dans les cellules de cancer du sein. L’expression d’ATGL est augmentée dans les lignées tumorales agressives et dans les cellules tumorales co-cultivées avec les adipocytes in vitro. L’inhibition d’ATGL ne permet plus la libération et l’utilisation des lipides stockés et entraine donc une diminution très importante des capacités invasives des cellules tumorales in vitro. Finalement, dans les tumeurs humaines, l’expression d’ATGL est corrélée à l’apparition de tumeurs de haut grade et son expression est augmentée au front invasif des tumeurs humaines (où les cellules tumorales sont en contact avec les adipocytes).
Ce travail montre donc que le transfert de lipides des adipocytes vers les cellules tumorales, qui représente une symbiose métabolique, est une étape importante de la dissémination des cancers du sein. Ces résultats ouvrent de nouvelles perspectives dans le traitement du cancer du sein via l’inhibition de l’activité des protéines impliquées dans le transport des lipides vers les mitochondries ou dans la libération des triglycérides stockés dans les gouttelettes. Ces cibles pourraient présenter un intérêt supplémentaire chez les sujets obèses dont les tumeurs sont plus agressives et où la taille (et donc le contenu lipidique) des adipocytes est augmentée.
Ces travaux ont été réalisés en collaboration avec l'Institut des maladies métaboliques et cardiovasculaires (Inserm/Université Toulouse III – Paul Sabatier) et du service d’Anatomo-Pathologie de l’Institut universitaire du cancer de Toulouse et ont bénéficié du soutien financier de l'Institut National du Cancer, de La Ligue contre le cancer (Comité Midi-Pyrénées) et de la Fondation de France.
© Catherine Muller
En savoir plus
-
Mammary adipocytes stimulate breast cancer invasion through metabolic remodeling of tumor cells.
Yuan Yuan Wang, Camille Attané, Delphine Milhas, Béatrice Dirat, Stéphanie Dauvillier, Adrien Guerard, Julia Gilhodes, Ikrame Lazar, Nathalie Alet, Victor Laurent, Sophie Le Gonidec, Denis Biard, Caroline Hervé, Frédéric Bost, Guo Sheng Ren, Françoise Bono, Ghislaine Escourrou, Marc Prentki, Laurence Nieto, Philippe Valet, and Catherine Muller.
JCI Insight. 2017;2(4):e87489. doi:10.1172/jci.insight.87489.