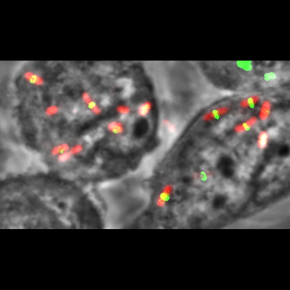
Les bactéries associées à la maladie de Crohn profitent des attaques de leur cellule hôte pour tolérer les antibiotiques
Dans une étude publiée dans la revue PLOS Pathogens, les chercheurs ont observé que les bactéries Escherichia coli associées à la maladie de Crohn enclenchent de multiples réponses aux stress pour survivre et se multiplier dans les macrophages ou globules blancs. La croissance dans cet environnement hostile confère à ces bactéries une forte tolérance aux antibiotiques.
La maladie de Crohn est une maladie chronique qui provoque une inflammation et une irritation du tube digestif. La maladie se caractérise par un déséquilibre du microbiome intestinal. En particulier, des souches d'Escherichia coli adhérentes invasives (AIEC) apparaissent dans la flore et ont été impliquées dans la maladie. Les AIEC colonisent les cellules intestinales, survivent et se répliquent dans les macrophages. Les AIEC sont des pathogènes intracellulaires originaux, ils ne semblent pas agresser leur cellule hôtes ni essayer d’échapper à l’arsenal que le macrophage met en place pour les tuer. Ils résident dans une vacuole toxique dont la fonction est de détruire bactéries, virus ou cellules endommagées.
Dans cette étude, les chercheurs démontrent que la souche AIEC LF82, lorsqu’elle est phagocytée par les macrophages, passe rapidement d'un état réplicatif à un état non réplicatif. Ce changement de phénotype résulte d'une réponse au stress appelée réponse stringente. Dans cet état de "semi-dormance", les bactéries deviennent tolérantes aux stress produits par le macrophage et une petite portion devient également tolérante aux antibiotiques. La tolérance a un antibiotique n’est pas une résistance, il n’y a pas d’acquisitions de mutations ou de gènes qui confèrent la résistance, c’est simplement un état physiologique des bactéries pour lesquels de nombreux antibiotiques sont inopérants.
Environ 10 heures plus tard, certaines bactéries font le changement inverse et redeviennent réplicatives, contribuant alors à augmenter la population bactérienne. Les bactéries qui redémarrent alors leur cycle cellulaire ont de grandes chances de mourir car elles ont accumulé des lésions, notamment sur leur ADN mais cette deuxième phase de l’infection permet toutefois d’augmenter sensiblement la population bactérienne et de créer des foyers contenants plusieurs dizaines de bactéries dans un macrophage. Cette deuxième phase a aussi pour effet d’augmenter la proportion de LF82 tolérantes aux antibiotiques jusqu'à 10 % de la population. En effet la croissance, dans ses conditions, qui restent stressantes, génère de nouvelles bactéries non réplicatives et éventuellement tolérantes aux antibiotiques. Les chercheurs ont observé que cette phase de réplication ne se produit pas lorsque des bactéries commensales ont été phagocytées par le macrophage, elle est caractéristique de LF82 et vraisemblablement de nombreuses AIEC. Les chercheurs ont pu modéliser ce processus infectieux et ainsi évaluer quantitativement la contribution de chaque étape pour la survie et la prolifération de LF82. Ces modèles suggèrent que, si les macrophages deviennent plus agressifs, l’ensemble d’une population intracellulaire de LF82 peut rapidement passer sous la forme de bactéries non réplicatives et donc potentiellement tolérantes aux antibiotiques. Cela suggère qu'un réservoir de bactéries tolérantes aux antibiotiques et non réplicatives pourrait être responsable de la survie à long terme dans l'hôte ainsi que des infections récurrentes.
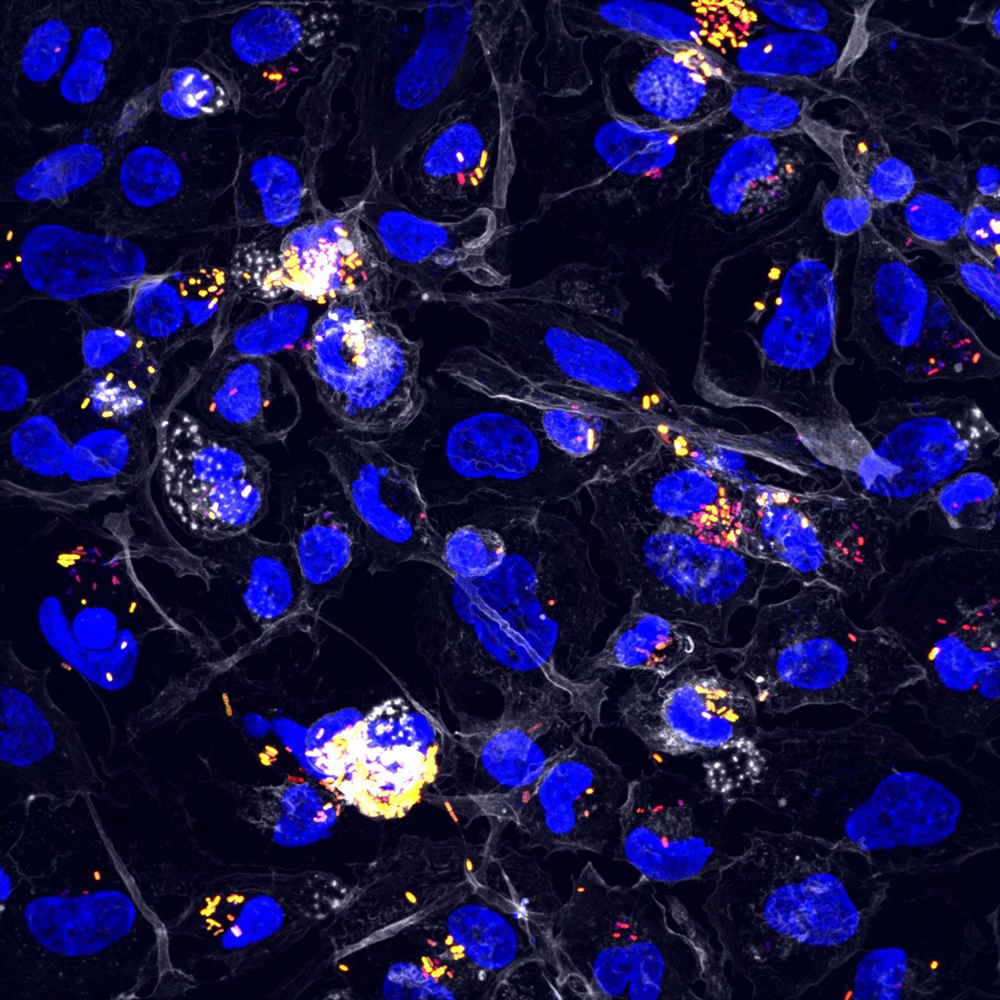
Figure : Macrophages infectés par la bactérie adhérente invasive AIEC LF82. Vingt-quatre heures après l’infection les AIEC ont formé des foyers réplicatifs (jaune) ou sont restées non réplicatives (rouges) à l’intérieur des macrophages. Le noyau des macrophages est coloré en bleu et son cytosquelette d’actine en blanc.
Pour en savoir plus:
The Crohn's disease-associated Escherichia coli strain LF82 relies on SOS and stringent responses to survive, multiply and tolerate antibiotics within macrophages.
Demarre G, Prudent V, Schenk H, Rousseau E, Bringer MA, Barnich N, Tran Van Nhieu G, Rimsky S, De Monte S, Espéli O.
PLoS Pathog. 2019 Nov 14;15(11):e1008123. doi: 10.1371/journal.ppat.1008123. eCollection 2019 Nov.