Le "talon d’Achille" du virus SARS-CoV-2
L’entrée d’un virus dans la cellule provoque des mécanismes de défense cellulaire permettant de combattre l’infection comme les interférons qui orchestrent la réponse antivirale. Dans une étude publiée dans la revue Nucleic Acids Research, les scientifiques ont montré que le virus SARS-CoV-2 annihile la réponse antivirale de la cellule par un mécanisme moléculaire inédit.
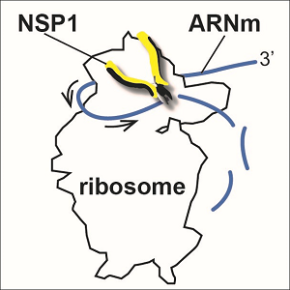
Dans un article publié dans la revue Nucleic Acids Research, les scientifiques ont étudié comment le virus SARS-CoV-2 favorise la traduction de son propre génome dans les cellules infectées en désactivant la traduction cellulaire. Lors des étapes précoces de l’infection, la protéine NSP1 est l’une des premières protéines virales produites. Cette protéine NSP1 va se fixer immédiatement sur le ribosome de la cellule hôte. Les chercheurs ont montré que la protéine NSP1 sur le ribosome va induire des coupures espacées régulièrement dans les ARN messagers de la cellule au fur et à mesure que le ribosome avance sur ces ARN messagers. Ainsi, tous les ARN messagers qui sont traduits seront dégradés en raison de la présence de la protéine NSP1. Or la traduction des ARNm est un processus fondamental qui permet à la cellule de produire les protéines nécessaires à sa survie, à son fonctionnement et à ses réponses aux stimuli extérieurs.
Les ARN du virus SARS-CoV-2 échappent à ces dégradations
Parmi les ARN messagers ciblés en priorité, les ARN messagers codant pour les protéines nécessaires à la réponse antivirale comme les interférons, seront dégradés en priorité. Ainsi, grâce à ce mécanisme moléculaire, le virus bloque les réactions antivirales de la cellule. En revanche, les ARN du virus SARS-CoV-2 échappent à ces dégradations et sont traduits normalement. Les scientifiques ont montré que les ARN du virus sont immunisés contre ces dégradations guidées par la protéine NSP1. En effet, le virus possède dans ses ARN messagers, une petite structure en épingle à cheveux appelée SL1 qui lui permet de protéger ses ARN contre les dégradations sur le ribosome en agissant sur NSP1. Le virus possède en quelque sorte une clé qui lui autorise la poursuite de la traduction virale alors que la traduction cellulaire s’éteint progressivement.
Le ‘talon d’Achille’ du virus SARS-CoV-2
Cette découverte est extrêmement importante puisqu’elle ouvre la voie à de nouvelles approches thérapeutiques antivirales visant à bloquer le cycle cellulaire du virus. En effet, le rôle primordial de SL1 dans le processus infectieux fait de cet élément du virus une cible de choix pour le développement de nouvelles molécules inhibitrices. De telles molécules seraient capables de bloquer spécifiquement l’action de SL1 permettant ainsi d’éteindre la traduction du virus. En résumé, le fait que SL1 soit indispensable à la traduction virale suggère que cette structure serait un véritable ‘talon d’Achille’ du virus.

SARS-CoV-2 NSP1 induces mRNA cleavages on the ribosome; Yann TARDIVAT, Piotr SOSNOWSKI, Antonin TIDU, Eric WESTHOF, Gilbert ERIANI, Franck MARTIN*. Publié dans Nucleic Acids Research; DOI: 10.1093/nar/gkad627
Contact
Laboratoire
Architecture et réactivité de l’ARN
UPR9002 CNRS
Institut de Biologie Moléculaire et Cellulaire
2 allée Konrad Roentgen
67084 Strasbourg cedex