Le réveil du chromosome X dans les cellules germinales des mammifères femelles
Chez les mammifères femelles, l’un des deux chromosomes X est inactivé dans les cellules somatiques. Cette inactivation est levée progressivement dans les cellules germinales primordiales, les futurs gamètes. Dans une étude publiée dans Nature Structural & Molecular Biology, des scientifiques révèlent que cette réactivation est progressive. Certaines régions du X restent silencieuses, ce qui suggère l’existence d’une « mémoire » liée à l’état inactivé. Cette étude offre un éclairage inédit sur la dynamique de la réactivation du chromosome X et ses implications pour la biologie de la reproduction.
L’inactivation du chromosome X : un mécanisme épigénétique indispensable
L’épigénétique est l’étude des modifications qui affectent l’expression des gènes, de façon héritable, sans changer la séquence de l’ADN. L’inactivation du chromosome X est un processus épigénétique clé chez les mammifères. L’inactivation permet d’équilibrer l’expression des gènes du chromosome X entre les femelles XX et les mâles XY. Au cours du développement embryonnaire, un des deux chromosomes X, de manière aléatoire dans chaque cellule, est inactivé, c’est-à-dire que ses gènes ne sont pas transcrits en ARN et donc pas traduits en protéines. Une fois ce chromosome éteint, il reste inactivé dans toutes les cellules des individus femelles tout au long de la vie, à l’exception des ovocytes. En effet, dans les cellules germinales primordiales, à l’origine des futurs gamètes (ovocytes chez les femelles), cette inactivation est levée progressivement. Cette réactivation a lieu très tôt, dans l’embryon, lorsque les cellules primordiales germinales apparaissent.
Comprendre la réactivation du X dans les cellules de la lignée germinale
Dans un article publié dans la revue Nature Structural and Molecular Biology, des scientifiques ont étudié les mécanismes sous-jacents à cette réactivation. Pour cette étude, ils ont croisé des lignées de souris génétiquement différentes avec, en conséquence, des chromosomes X différenciables. Ils ont ainsi pu étudier les ARN des gènes du chromosome X et mesurer quelle proportion de ces ARN provenaient du chromosome inactif, grâce à leurs différences de séquences.
Afin de déterminer précisément quand la réactivation des gènes du chromosome X a lieu dans les futurs gamètes, les scientifiques ont donc analysé l’expression de tous les gènes du chromosome X, à l’échelle de la cellule unique dans les cellules germinales primordiales de souris. Au cours d’une fenêtre de développement embryonnaire de quatre jours (entre 9,5 jours et 12,5 jours de développement), les cellules germinales primordiales migrent, prolifèrent, et initient leur réactivation séquentiellement. Les résultats montrent que, bien que la majorité des gènes du chromosome X soient progressivement réactivés au cours du développement, certaines régions restent plus longtemps silencieuses. En effet, à 12.5 jours de développement embryonnaire, un groupe de gènes résiste à la levée de l’inactivation. La localisation et l’environnement épigénétique de ces gènes semblent être clés dans la résistance à la réactivation. Le fait d’être un gène précocement éteint au cours de l’inactivation du chromosome X semble déterminant pour sa future résistance à la réactivation. Ces éléments suggèrent qu’une mémoire épigénétique persiste pour certains gènes.
La réactivation du X n’est pas un phénomène homogène
Pour mieux comprendre l’environnement épigénétique impliqué dans la mémoire de l’état silencieux du chromosome X, les scientifiques ont utilisé des techniques de pointe afin d’étudier les modifications épigénétiques au niveau de l’ensemble des gènes du chromosome X. Ces techniques permettent en particulier d’examiner le degré de méthylation de l’ADN et les modifications des histones, des protéines qui entourent la molécule d’ADN. Les régions associées à une inactivation prolongée présentent une forte concentration de marques épigénétiques répressives, notamment la tri-méthylation de la lysine 27 sur l’histone 3 (H3K27me3), contrairement aux régions réactivées précocement. De plus, les derniers gènes à se réactiver présentent un niveau plus élevé de méthylation de l’ADN au niveau de leurs promoteurs, des séquences en amont des gènes qui sont importantes dans le contrôle de leur expression, en comparaison avec ceux dont l’inactivation est levée précocement.
Ces découvertes offrent un aperçu inédit de la cartographie transcriptionnelle et chromatinienne du chromosome X dans les cellules germinales primordiales. Cette étude suggère que la réactivation du chromosome X n’est pas un phénomène homogène, mais un processus progressif dépendant de la mémoire épigénétique héritée de l’inactivation. Elle ouvre aussi la voie à de futures recherches visant à mieux comprendre comment ces marques répressives sont levées et quels mécanismes sont en jeu.
L’étude met en évidence l’importance d’examiner la reprogrammation épigénétique dans le contexte du développement de la lignée germinale, en tenant compte du sexe de l’individu. Ces résultats soulèvent la question de l’impact et du rôle de la double dose de certains gènes du chromosome X, au moment de la réactivation, sur le bon développement de la lignée germinale femelle. Les études qui en découleront pourraient avoir des implications dans notre compréhension de la fertilité féminine, des pathologies liées à la dérégulation du chromosome X, et des symptômes liés aux aneuploïdies sexuelles telles que le syndrome de Turner.
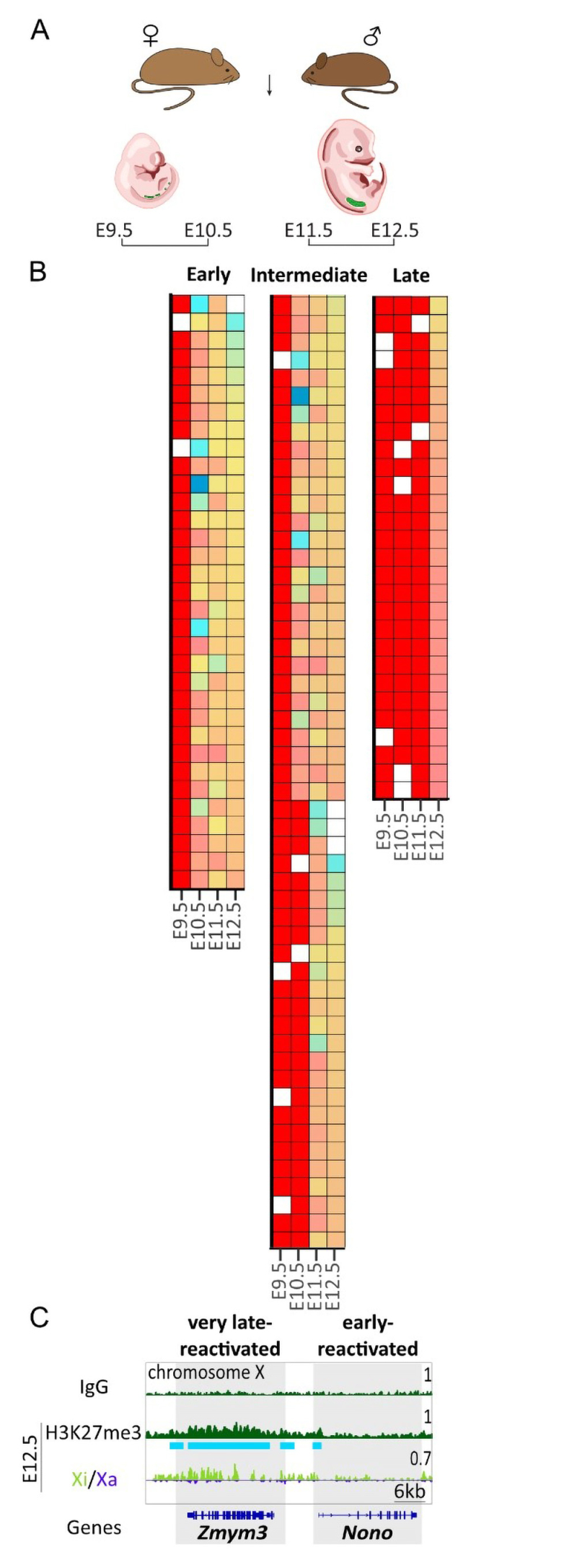
Figure : Réactivation du chromosome X au cours du développement des cellules germinales primordiales.
A) Croisement de sous-espèces de souris permettant d’obtenir des embryons porteurs de polymorphismes. Les embryons femelles sont collectés entre 9.5 jours (E9.5) et 12.5 jours de développement embryonnaire (E12.5). B) Les gènes du chromosome X inactif sont classés par groupe de cinétique de réactivation (précoce/early, intermédiaire / intermediate, tardif / late). Les escapees sont des gènes connus pour s’exprimer à partir des deux chromosomes X et ne pas subir l’inactivation du chromosome X. Les gènes early sont réexprimés à partir du chromosome X inactif dès E10.5, puis viennent les gènes intermediate et enfin les gènes late à E12.5. C) Un exemple de profils d’enrichissement pour la marque répressive des histones, H3K27me3, au niveau des gènes early (Nono) et very late (Zmym3). Zmym3 est enrichi en marques répressives de manière globale (vert foncé) et plus précisément sur le chromosome X inactif (vert clair) à E12.5, ce qui pourrait expliquer sa non-réactivation, contrairement au gène Nono, qui, lui, n’est pas enrichi et est déjà réactivé.
Référence : Temporal and regional X-linked gene reactivation in the mouse germline reveals site-specific retention of epigenetic silencing. Roidor C., Syx L., Beyne E., Raynaud P., Zielinski D., Teissandier A., Lee C., Walter M., Servant N., Chebli K., Bourc’his D., Surani M.A., Borensztein M.
Nature Structural & Molecular Biology, 21 janvier 2025, DOI : 10.1038/s41594-024-01469-2.