Le réparateur réparé : RecA sous surveillance d’un système antioxydant
Les recombinases RecA/Rad51 sont des protéines essentielles à la stabilité des génomes de tous les organismes vivants. Le rôle de RecA est primordial pour réparer les dommages causés par l’oxydation de l’ADN. Cette nouvelle étude publiée dans la revue eLife, montre que RecA elle-même est inactivée par le stress oxydant et rapporte sur le rôle essentiel des protéines MsrA/B dans la réactivation de RecA.
L’utilisation de l’oxygène par les organismes vivants entraine la formation d’espèces radicalaires extrêmement toxiques capables d’endommager leurs propres composants cellulaires tel que l’ADN et les protéines. Pour pallier ce problème, les êtres vivants possèdent un arsenal de défense prévenant les dommages du stress oxydant. Au sein des protéines, les résidus méthionine sont l’une des cibles privilégiées des radicaux libres en les transformant en méthionines sulfoxydes. Cette oxydation est cependant réversible grâce à l’action d’enzymes conservées dans tous les règnes du vivant appelées MSR (Méthionine Sulfoxyde Réductase). En réparant les protéines oxydées, les MSR sont ainsi au cœur des systèmes antioxydants cellulaires.
Les recombinases RecA/Rad51 sont des protéines essentielles à la stabilité des génomes chez tous les organismes vivants. Chez la bactérie modèle Escherichia coli, RecA catalyse la recombinaison homologue et le déclenchement de la réponse SOS permettant ainsi la réparation de dommages à l’ADN. Lors d’un stress oxydant, l’ADN peut être endommagé et sa réparation par l’action de RecA est donc primordiale pour maintenir l’intégrité du génome.
En étudiant l’impact du stress oxydant sur les protéines (le "protéome") de la bactérie E. coli, les chercheurs ont découvert que les résidus méthionine de la protéine RecA sont des cibles privilégiées des radicaux libres. Par des approches complémentaires de génétique et de biochimie, dans le cadre d'une collaboration internationale avec l’Université de Séville et l’Université de Wisconsin-Madison, les scientifiques ont découvert que l’oxydation de la protéine RecA entraine une perte de son activité, l’empêchant de réparer les dommages à l’ADN.
Les chercheurs ont montré que le système de réparation des protéines oxydées (MsrA/B) était capable de réactiver la protéine RecA, démontrant le rôle central des MSR dans le maintien de homéostasie cellulaire. Cette étude démontre qu’en plus d’endommager directement l’ADN, le stress oxydant en perturbe l’intégrité en détériorant l’activité protéique chargée de sa réparation.
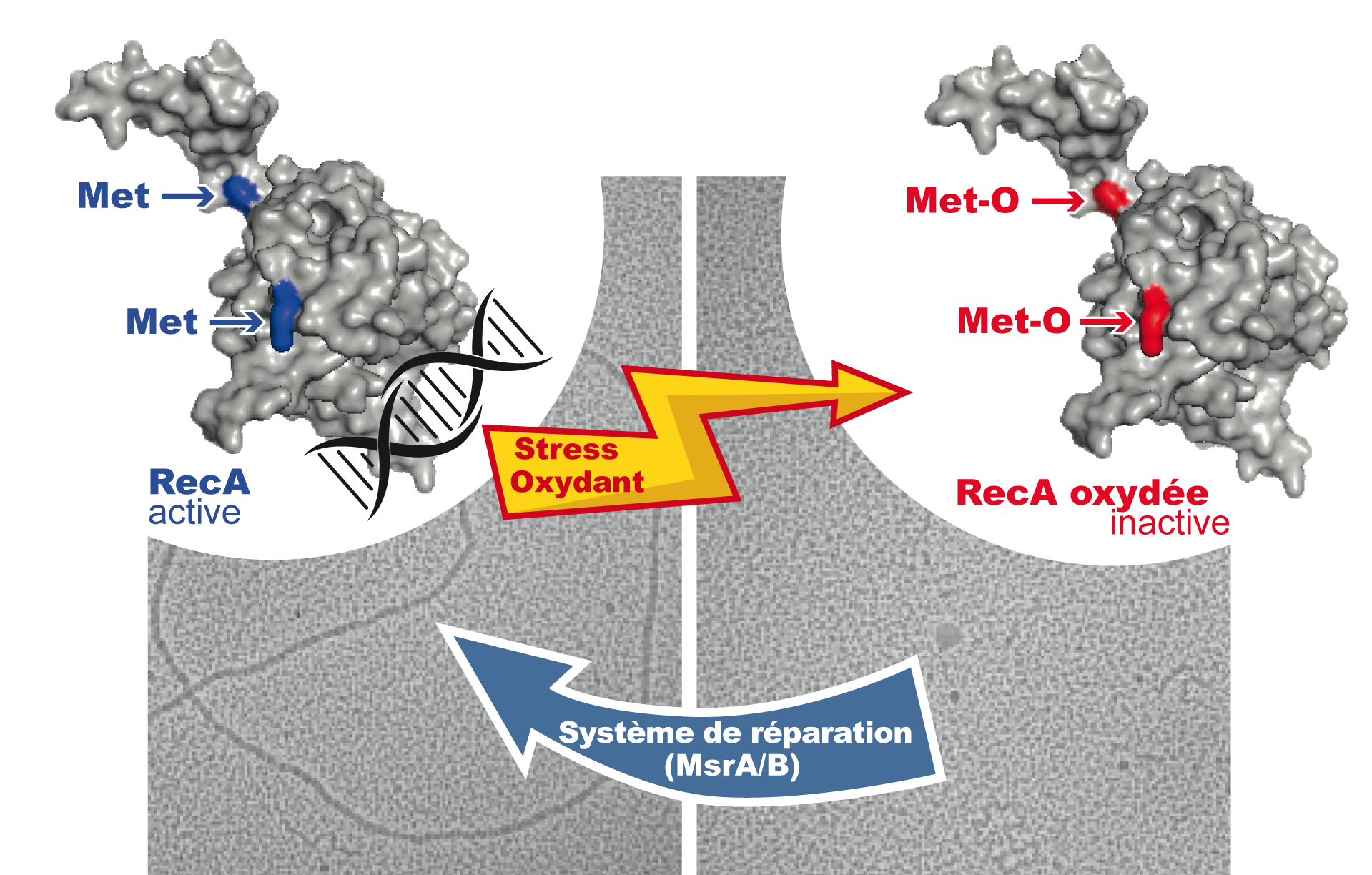
Figure : La forme réduite de RecA est capable de se polymériser autour d’une molécule d’ADN observable par microscopie électronique. Lors d’un stress oxydant, la protéine RecA est oxydée sur ses résidus méthionine ce qui entraine une perte d’activité. Le système de réparation des protéines oxydées, MsrA/B, est capable de restaurer l’activité de RecA.
Pour en savoir plus:
Redox controls RecA protein activity via reversible oxidation of its methionine residues
Henry C, Loiseau L, Vergnes A, Vertommen D, Mérida-Floriano A, Chitteni-Pattu S, Wood EA, Casadesús J, Cox M, Barras F, Ezraty B
eLife. 2021 Feb19. doi: 10.7554/eLife.63747.
Contact
Laboratoires
- Laboratoire de chimie bactérienne (LCB) - (CNRS/Aix-Marseille Université)
31 chemin Joseph Aiguier
13009 Marseille -
Institut Pasteur - (CNRS/Institut Pasteur)
Département de Microbiologie
Rue du Docteur Roux, Paris