Le récepteur MET, une des clefs de l’équilibre des forces entre vie et mort cellulaire
On estime à quelques dizaines de milliards le nombre de cellules qui meurent chaque jour chez un être humain. Pour assurer l’homéostasie des tissus et de l’organisme, il est important que les cellules maintiennent un bon équilibre survie/mort. Dans une étude publiée dans la revue eLife, les scientifiques montrent que le récepteur MET, dont on connaissait le rôle dans la survie des cellules du foie, peut également induire leur mort cellulaire dans certaines conditions. Cette dualité du récepteur MET, porteur de forces opposées et complémentaires, en fait une cible intéressante pour de nouvelles stratégies visant à moduler finement l’équilibre cellulaire.
La capacité des cellules à ajuster leur balance survie/mort cellulaire en fonction des signaux qu’elles perçoivent dans leur microenvironnement est cruciale dans la physiologie d’un organisme. De nombreuses pathologies sont ainsi associées à une dérégulation de cet équilibre. En fonction des signaux de survie ou des stress perçus, les cellules adaptent notamment leur signalisation afin de répondre à ces stress. Si elles n’y arrivent pas, elles disposent de mécanismes de mort cellulaire programmée, ou apoptose, grâce à laquelle est éliminée une menace potentielle pour l’organisme.
Il existe dans nos cellules une famille de récepteurs à deux facettes, appelés récepteurs à dépendance, dédiés à la gestion du choix des cellules entre survie et mort cellulaire. Ils sont en effet capables de favoriser la survie lorsqu’ils perçoivent un signal spécifique ou, au contraire, de faire basculer les cellules vers la mort en l’absence de ce signal. Bien souvent cette dernière activité est contrôlée par un clivage du récepteur par des enzymes appelées caspases, associées principalement à l’apoptose. Cette dualité de fonctions, bien qu’intuitivement contradictoire, permet aux cellules de maintenir leur équilibre survie/mort en ajustant ces deux forces opposées, pour maintenir un équilibre dans l’organisme.
Dans ce contexte, les chercheurs ont récemment mis en évidence que le récepteur MET, bien connu pour favoriser la survie cellulaire, est également capable d’amplifier la mort des hépatocytes en conditions de stress. Pour cela, ils ont généré un nouveau modèle de souris transgéniques, dans lequel a été invalidé un site de clivage de MET par les caspases, ce qui l’empêche de favoriser la mort cellulaire. On montre alors que les hépatocytes de ces souris sont plus résistants à la mort induite par un stress hépatotoxique. Par l’utilisation de cultures primaires de cellules progénitrices du foie, capables de se multiplier pendant des semaines en boîtes de Petri, les chercheurs ont pu évaluer différentes conditions expérimentales d’induction de mort in vitro, mais aussi décrypter les mécanismes moléculaires impliquées dans ce processus.
La fonction d’une protéine cellulaire est fortement déterminée par sa localisation et les partenaires moléculaires qu’elle rencontre dans la cellule. La double personnalité du récepteur MET illustre bien cette notion. Les scientifiques montrent que, alors le récepteur MET complet se trouve localisé à la membrane plasmique (où il peut répondre à son ligand présent dans l’espace extracellulaire), le fragment libéré suite au clivage de MET par les caspases se relocalise au niveau de zones d’échange entre le reticulum endoplasmique et les mitochondries. En collaboration avec des équipes spécialisées dans l’étude des flux calciques, ils prouvent que cette localisation de MET favorise une surcharge calcique des mitochondries, une étape clef de la mort cellulaire.
Ainsi, grâce à ce travail collectif mettant en œuvre des approches interdisciplinaires, les chercheurs ont établi l’appartenance de MET à la famille des récepteurs à dépendance et son rôle clé dans l’équilibre cellulaire. De manière cohérente, une baisse de l’activité pro-survie de MET est associée à des maladies dégénératives, tandis que des mutations de MET détectées dans différents cancers favorisent cette action pro-survie et/ou réduisent son action pro-mort cellulaire. Cette étude pourrait ouvrir la porte à de nouvelles stratégies thérapeutiques pour essayer de restaurer un équilibre adéquat entre survie et mort cellulaire.
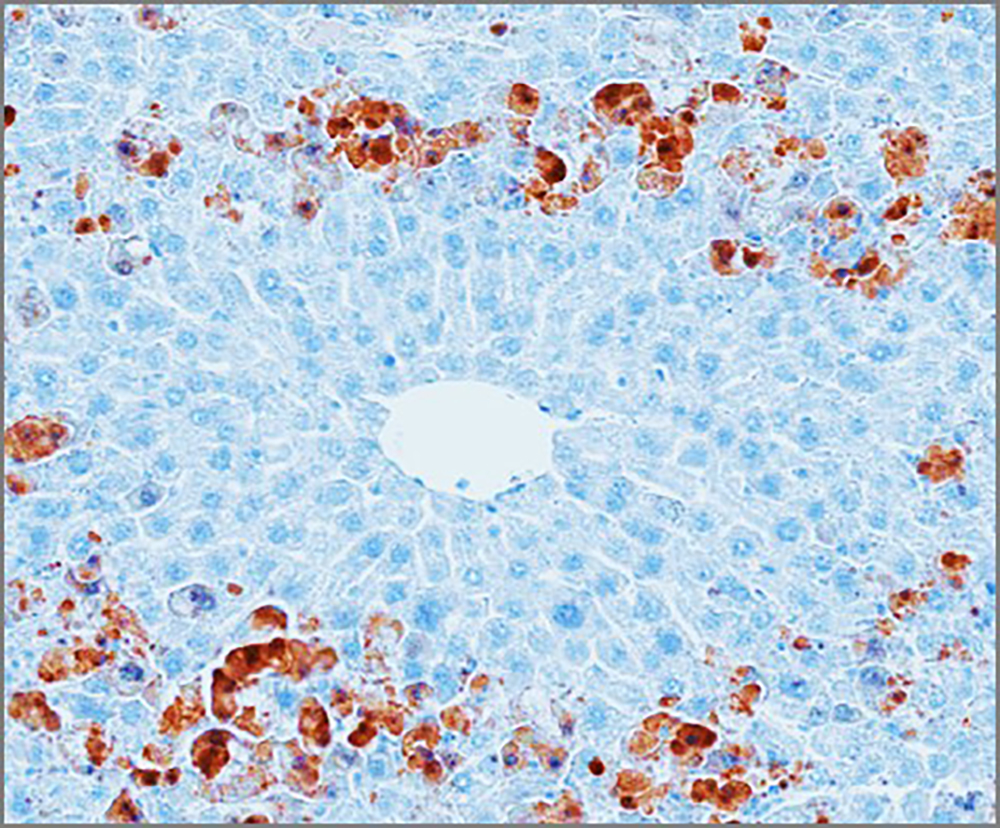
Figure : Coupe d’un lobule hépatique de foie de souris, organisé autour d’une veine centrolobulaire, traité avec un inducteur d’apoptose. Un marquage de la caspase 3 activée permet la détection en brun/rouge des cellules apoptotiques en périphérie du lobule.
Pour en savoir plus :
Control of cell death/survival balance by the MET dependence receptor.
Duplaquet L, Leroy C, Vinchent A, Paget S, Lefebvre J, Vanden Abeele F, Lancel S, Giffard F, Paumelle R, Bidaux G, Heliot L, Poulain L, Furlan A, Tulasne D.
Elife. 2020 Feb 24;9. pii: e50041. doi: 10.7554/eLife.50041.
Contact
Laboratoire
Laboratoire CanTher « Hétérogénéité, Plasticité et Résistance aux Thérapies des Cancers » (CANTHER) - (CNRS/Inserm/Université de Lille)
place de Verdun, 59045 Lille
