Le récepteur 5-HT6 de la sérotonine : quand changer de partenaire permet de changer de rôle
Les récepteurs couplés aux protéines G (RCPG) sont la cible de plus de 30% des médicaments sur le marché. Ce ne sont pas des protéines membranaires isolées car elles interagissent avec des réseaux complexes de protéines, qui jouent ainsi un rôle clé dans leurs fonctions physiologiques. Une étude publiée dans Science Signaling démontre l’importance de la dynamique des interactions entre un RCPG et ses partenaires protéiques dans un processus physiologique complexe, la différentiation neuronale.
Les récepteurs couplés aux protéines G (RCPG) constituent la famille la plus nombreuse des récepteurs membranaires (> 800 gènes représentant plus de 1% du génome humain) et sont les cibles de plus de 30% des médicaments actuellement sur le marché. Au cours des deux dernières décennies, la vision de la transduction du signal par les RCPG a été radicalement modifiée : le modèle classique à 3 partenaires (1 ligand, 1 récepteur et 1 effecteur) et 2 états conformationnels (1 état inactif et 1 état actif avec le récepteur lié à un agoniste) a évolué vers un modèle plus complexe (multiples effecteurs et multiples conformations). Cette évolution a été suggérée par des cribles protéomiques indiquant que les RCPG ne fonctionnaient pas sous la forme de protéines isolées au sein de la membrane plasmique, mais qu’ils interagissaient avec des réseaux complexes de protéines, notamment des protéines impliquées dans la transduction du signal et leur régulation fonctionnelle.
Les études sur les RCPG ne peuvent donc plus uniquement se focaliser sur la protéine réceptrice prise individuellement, mais doivent prendre en considération le réseau de protéines auquel il est associé. Ceci soulève la question de la dynamique spatio-temporelle des interactions entre un RCPG et ses partenaires protéiques.- A quel(s) partenaire(s) le récepteur est-il associé au cours du temps et selon le type cellulaire (ou le compartiment cellulaire) où il est localisé ? - Quel est l’impact de cette dynamique sur les processus physiologiques contrôlés par le récepteur ?
La sérotonine est un des neurotransmetteurs capables de stimuler le plus grand nombre de récepteurs, expliquant en partie la diversité de ses fonctions physiologiques au cours du développement et chez l’adulte. Quatorze sous-types de récepteurs de la sérotonine ont été identifiés, dont 13 sont des RCPG. Parmi ceux-ci, le récepteur 5-HT6 est un récepteur couplé à la protéine Gs qui suscite un intérêt particulier, car il contrôle des processus-clé neuro-développementaux comme la migration et la différentiation neuronale. Il constitue une cible prometteuse pour le traitement des déficits cognitifs associés aux maladies neuro-développementales et aux démences.
Des cribles interactomiques ont révélé que ce récepteur interagit avec un large réseau de partenaires protéiques, incluant la protéine Cyclin-dependent kinase (Cdk)5 connue pour son rôle dans le développement neuronal. Des études fonctionnelles ont démontré que l’association du récepteur à la Cdk5 permet une activation constitutive (ne requérant pas la liaison du récepteur à un agoniste) de la Cdk5 et que ce mécanisme, indépendant de la protéine Gs et de la production d’AMP cyclique, est impliqué dans la migration neuronale et l’initiation de la croissance neuritique. L’étude montre dans plusieurs modèles de neurones en culture que le récepteur s’associe de façon séquentielle avec la Cdk5 et un autre partenaire, la protéine GPRIN1 (G-Protein Regulated Inducer of Neurite outgrowth) lors de la différentiation neuronale. L’association du récepteur à GPRIN1 permet l’allongement des neurites et une complexification de l’arbre dendritique par un mécanisme dépendant de la stimulation de la protéine Gs, de la production d’AMP cyclique et de l’activation de la protéine kinase A.
Cette étude démontre une régulation complexe de l’activité du récepteur par ses partenaires protéiques et indique que la dynamique d’interaction entre le récepteur et des partenaires différents lui permet de finement contrôler un processus neuro-développemental complexe et hautement coordonné comme la croissance et la maturation de l’arbre dendritique.
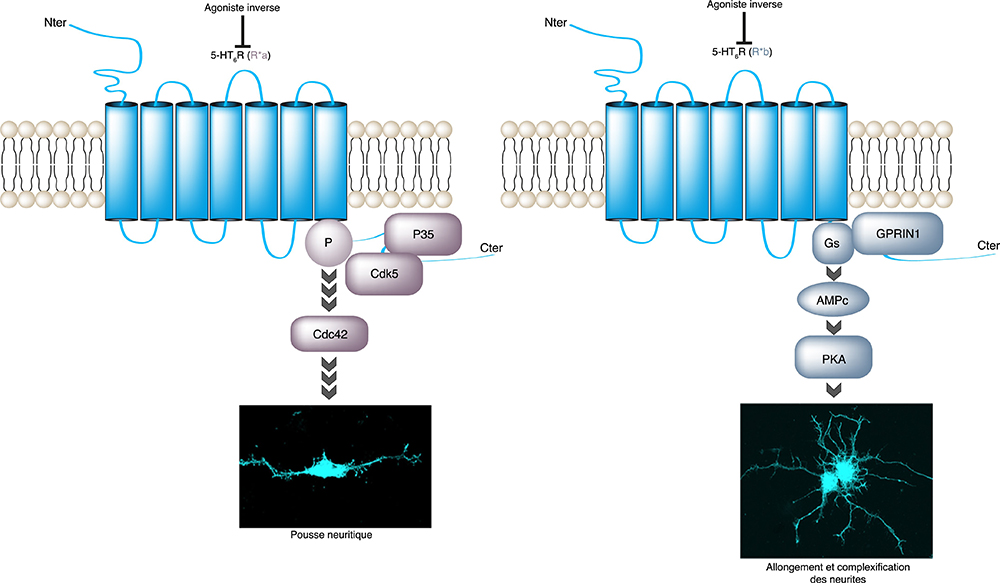
Figure : Interaction séquentielle entre le récepteur 5-HT6 et Cdk5 ou GPRIN1, rôle dans la morphogenèse de l’arbre dendritique. L’association du récepteur 5-HT6 à la Cdk5 résulte en la phosphorylation du récepteur sur un résidu Sérine localisé dans sa partie C-terminale (Cter). Cette étape stimule l’initiation de la pousse neuritique de façon indépendante de l’agoniste, via une signalisation dépendante de Cdc42 et indépendante de Gs (gauche). L’association du récepteur à GPRIN1 permet le recrutement de la protéine Gs activée, ce qui conduit à l’élongation et la complexification des neurites, par un mécanisme indépendant de l’agoniste mais impliquant la protéine kinase A (droite). Ces effets dépendent d’une activation constitutive du récepteur (indépendante de la liaison d’un agoniste), comme l’indique leur inhibition par un agoniste inverse . Nter = N-terminal.
Pour en savoir plus:
Dynamic interactions of the 5-HT6 receptor with protein partners control dendritic tree morphogenesis.
Pujol CN, Dupuy V, Séveno M, Runtz L, Bockaert J, Marin P, Chaumont-Dubel S.
Sci Signal. 2020 Feb 11;13(618). pii: eaax9520. doi: 10.1126/scisignal.aax9520.
Contact
Laboratoire
Institut de Génomique Fonctionnelle (IGF) - (CNRS/Inserm/Université de Montpellier)
141 rue de la Cardonille, 34094 Montpellier Cedex 5