Le magnésium, élément clé de la structure et de la fonction des ARN
Dans une étude publiée dans Nucleic Acids Research, des scientifiques montrent le rôle crucial des ions magnésium dans la structure et la fonction de l’ARN, notamment dans les ribosomes, les usines à protéines de la cellule. Grâce à une analyse fine d’une structure obtenue par cryo-microscopie électronique, technique qui permet une analyse à l’échelle de l’atome, et obtenue par un autre groupe, ils ont découvert des motifs de fixation inédits de ces ions. Ces avancées sont essentielles au développement de logiciels de prédiction de repliement d’ARN complexes.
Le rôle clé des ions magnésium dans la structure et la fonction de l’ARN
Dans une étude, publiée dans Nucleic Acids Research, les scientifiques mettent en lumière l'importance des ions Mg²⁺ pour la structure et la fonction de l’ARN, en particulier dans les ribosomes, les usines à protéines de nos cellules. Ces ions aident l’ARN à adopter une forme précise et stable tout en jouant un rôle essentiel dans certaines réactions chimiques.
Bien que plusieurs tentatives de classification des sites de liaison du Mg²⁺ aient été entreprises dans le passé, elles ont souvent échoué en raison de limitations dans la résolution des modèles et de mauvaises assignations de certains ions.
Des découvertes inédites pour mieux comprendre et modéliser les ARN
Les scientifiques ont donc réanalysé une structure déjà publiée de ribosome d’Escherichia coli obtenue par cryo-microscopie électronique (cryo-EM) à une résolution (1,55 Å) permettant de visualiser chaque atome de la molécule. Cela leur a permis de mieux comprendre comment le magnésium se lie à l'ARN, de corriger des erreurs dans les modèles existants et de découvrir de nouveaux modes d’interactions de ces ions avec l'ARN. Par exemple, ils ont découvert des motifs de nucléation inédits où jusqu'à cinq nucléotides adjacents s’enroulent autour d’un seul ion Mg²⁺, ainsi que des clusters de molécules d’eau associés aux ions, révélant un niveau d’organisation jusque-là insoupçonné. Grâce à une analyse détaillée de la stéréochimie des liaisons, ils ont pu identifier et corriger des erreurs d'assignation d'ions, ainsi que caractériser de nouvelles configurations de liaison du Mg²⁺, qui n’avaient pas été observées auparavant.
Vers un « Alphafold » dédié à l’ARN
Cette recherche propose une classification détaillée des sites de liaison de Mg²⁺, qui permet de mieux comprendre le rôle de ces ions dans le repliement de l'ARN et les interactions qu’ils établissent au sein du ribosome, mais également dans d’autres systèmes biologiques. En outre, les scientifiques ont proposé des règles de placement stéréochimiques permettant d’assigner presque tous les ions Mg²⁺ impliqués dans des événements de repliement essentiels intervenant lors de la biogenèse des ribosomes. Ils insistent sur l’importance de la formation de paires d’ions Mg²⁺...Mg²⁺/K⁺ identiques à celles trouvées dans certains systèmes catalytiques, fournissant un cadre pour identifier de nouvelles interactions ioniques dans les ARN catalytiques et non catalytiques.
Ces découvertes dépassent le cadre des ribosomes, offrant la possibilité non seulement d’améliorer la modélisation des nouvelles structures d’ARN, mais également de corriger celles déjà déposées dans les bases de données structurales. Cela bénéficiera à l’ensemble de la communauté scientifique, notamment en jetant les bases pour le développement futur d’un "équivalent Alphafold" dédié à l’ARN, « Alphafold » étant le logiciel de prédiction de structure des protéines qui a valu le prix Nobel de chimie 2024 à ces auteurs. De plus, ces avancées auront des implications médicales importantes, notamment dans le développement de médicaments ciblant les ARN en permettant une meilleure compréhension de la structure et de l’organisation de ces systèmes.
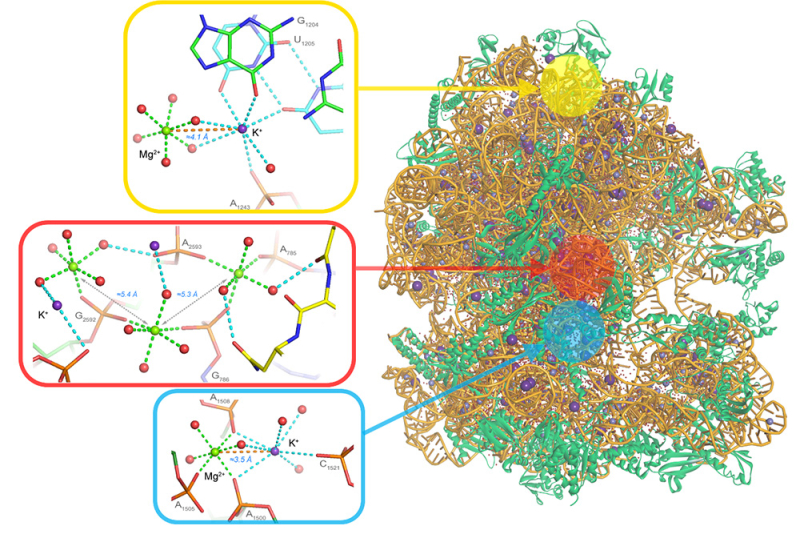
Figure : Vue détaillée de trois clusters de cations identifiés dans la structure du ribosome à très haute résolution. En haut (jaune) un cluster Mg2+…K+ où le magnésium est entièrement hydraté (hexahydrate). Au milieu (en rouge) un cluster 3 Mg2+…2 K+ localisé dans le cœur du ribosome. En bas (en bleu) un détail d’un cluster Mg2+…K+ où le magnésium est partiellement deshydraté du fait de contacts directs avec l’ARN. Cette illustration souligne l’importance des clusters cationiques pour la bonne structuration du ribosome en particulier, et de l’ARN en général.
Pour en savoir plus :
Principles of ion binding to RNA inferred from the analysis of a 1.55 Å resolution bacterial ribosome structure – Part I: Mg2+
Filip Leonarski, Anja Hennind-Knetchel, Serdal Kirmizialtin, Eric Ennifar, Pascal Auffinger
Nucleic Acids Research, gkae1148, https://doi.org/10.1093/nar/gkae1148
Contact
Laboratoire
Architecture et réactivité de l’ARN - ARN (CNRS)
Institut de Biologie Moléculaire et Cellulaire
2 Allée Conrad Roentgen
67084 Strasbourg CEDEX