Le macrophage résident, chef d’orchestre du processus de régénération
Dans le règne animal, plusieurs espèces ont la capacité de régénérer complètement la structure et la fonction de parties complexes de leur corps après une amputation ou une lésion. Chez le mammifère et l’Homme adultes, ces capacités régénératives sont complètement perdues. L’objectif de ce travail a été de déterminer les mécanismes cellulaires à l’origine de la régénération afin d’identifier les verrous qui le bloquent chez le mammifère adulte. Les résultats sont publiés dans la revue NPJ Regenerative Medicine.
La réparation tissulaire à la suite d’une lésion est un processus complexe qui conduit chez certains vertébrés comme les amphibiens à la régénération des tissus, ce qui permet la récupération d’une structure et de fonctions identiques au tissu originel. Chez le mammifère et l’Homme adultes, la réparation tissulaire conduit le plus souvent à une cicatrisation associée à une perte de fonction du tissu lésé. La compréhension des mécanismes qui contrôlent l’issue de la réparation tissulaire et bloquent la régénération chez le mammifère adulte est donc un enjeu majeur.
L’issue de la réparation tissulaire est en partie conditionnée par la phase inflammatoire qui suit la lésion du tissu, et qui, lorsqu’elle est mal résolue, entraine la mise en place d’une fibrose. Les macrophages sont des cellules clés de la résolution de l’inflammation notamment grâce à leur capacité d’élimination des débris cellulaires (efférocytose) et leur conversion d’un profil pro-inflammatoire vers un profil pro-résolutif. Ces cellules constituent une population très hétérogène et des études récentes montrent que selon leur origine (médullaire ou tissulaire), les macrophages semblent être impliqués de façon différente dans le processus inflammatoire.
Les scientifiques ont récemment développé un modèle de régénération tissulaire induite dans le tissu adipeux, chez la souris adulte, permettant de comparer les premières étapes des processus de régénération et de cicatrisation. En utilisant des études de gain et de perte de fonction et des approches de déplétion cellulaire spécifique, leurs travaux démontrent que la régénération tissulaire chez les mammifères adultes dépend d'un pic précoce et transitoire de neutrophiles produisant des espèces réactives de l'oxygène et de leur efférocytose par les macrophages. Cette efférocytose est associée à l’arrêt de la sécrétion par les macrophages de médiateurs pro-inflammatoires au profit de médiateurs anti-inflammatoires. Grâce à l’utilisation d’un modèle de chimères hématopoïétiques, ces résultats montrent que les macrophages résidents dans le tissu orientent le processus de réparation vers la régénération grâce à une efférocytose efficace, contrairement aux macrophages médullaires qui entretiennent l'inflammation et favorisent ainsi la cicatrisation. En l’absence de macrophages résidents, le tissu est incapable de régénérer.
Ces résultats mettent en évidence des voies cellulaires clés et précoces capables d’orienter la réparation des tissus vers la régénération chez les mammifères adultes, ainsi que des cibles potentielles qui pourraient être manipulées pour induire la régénération dans un contexte de lésion tissulaire.
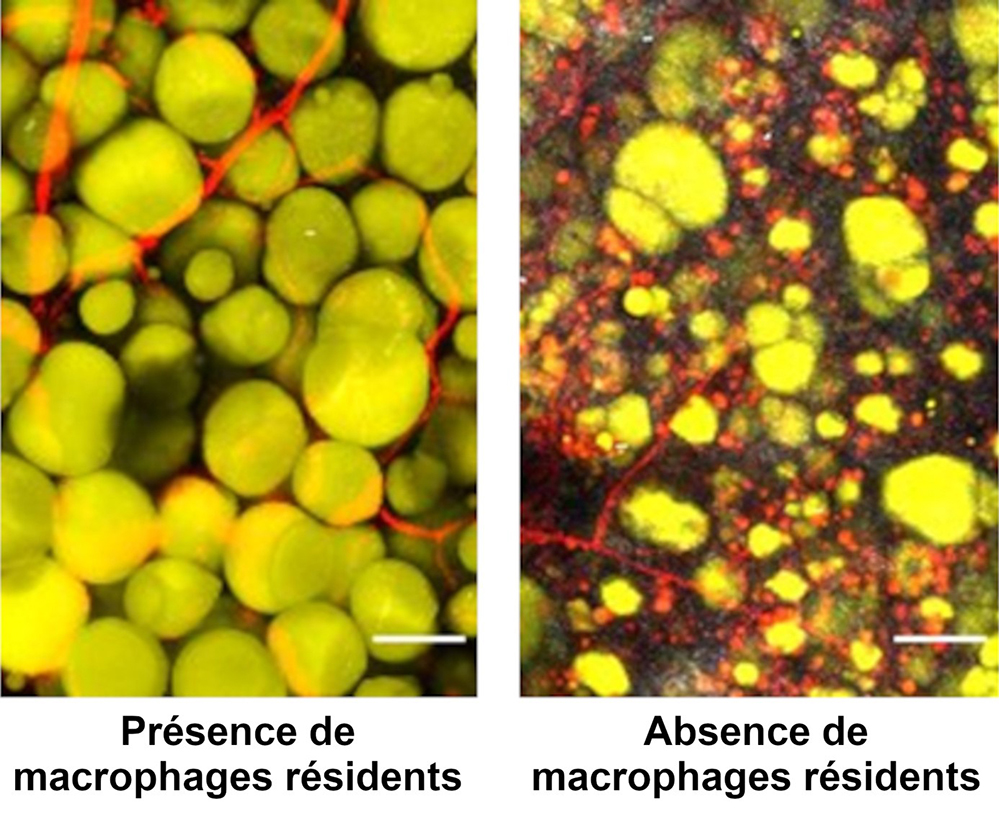
Figure : Images représentatives du tissu en présence ou non de macrophages résidents, un mois après la lésion. Seule l’image de gauche montre un tissu comparable au tissu d’origine. Pour permettre leur visualisation, les adipocytes (jaunes) ont été colorés avec du Bodipy et les vaisseaux (rouges) avec une injection de Lectine in vivo. Les fibres de collagène (gris) ont été imagées en utilisant le signal de seconde harmonique (barre d'échelle : 50µm).
Pour en savoir plus :
Driving regeneration, instead of healing, in adult mammals: the decisive role of resident macrophages through efferocytosis.
Lise Rabiller, Virginie Robert, Adèle Arlat, Elodie Labit, Marielle Ousset, Marie Salon, Agnès Coste, Léa Da Costa-Fernandes, Paul Monsarrat, Bruno Ségui, Mireille André, Christophe Guissard, Marie-Laure Renoud, Marine Silva, Gilles Mithieux, Isabelle Raymond-Letron, Luc Pénicaud, Anne Lorsignol, Louis Casteilla, Cécile Dromard Berthézène, Béatrice Cousin
NPJ Regenerative Medicine 3aout 2021. https://doi.org/10.1038/s41536-021-00151-1
Contact
laboratoire
RESTORE (CNRS, Inserm, EFS, ENVT, Université de Toulouse)
4bis avenue Hubert Curien – 31100 Toulouse
STROMALab – Université de Toulouse, CNRS ERL5311, EFS, INP-ENVT, Inserm U1031, UPS
Bâtiment INCERE
4bis avenue Hubert CURIEN
31100 TOULOUSE
CRCT
Centre de Recherches en Cancérologie de Toulouse
2 avenue Hubert Curien – 31037 Toulouse CEDEX 1 – FRANCE