L’analyse mathématique pour mieux comprendre les mécanismes de la division cellulaire
Dans un article publié dans la revue PLoS Computational Biology, des scientifiques ont utilisé une approche de science des données pour étudier les variations observées entre différentes cellules dans la formation du fuseau. Cette structure permet la migration des chromosomes lors de la division cellulaire, assurant sa fidélité. En particulier, ils ont montré que trois paramètres sont suffisants pour expliquer cette variabilité.
Une approche de science des données pour étudier la variabilité cellulaire
Chaque cellule est différente de sa voisine. Quantifier cette variabilité est indispensable car elle contient des informations importantes sur les mécanismes cellulaires sous-jacents.
Dans un article publié dans la revue PloS Computational Biology les scientifiques se sont intéressés à la longueur du fuseau mitotique, qui se forme pour permettre la migration des chromosomes lors de la division cellulaire, pour étudier cette variabilité. Cette mesure est utilisée couramment pour indiquer si la division se passe correctement.
Ils ont utilisé le ver nématode, Caenorhabditis elegans, pour mener à bien cette étude. En effet, chez ce modèle, les divisions cellulaires sont bien connues et se produisent de manière reproductible. De plus il est facile de manipuler le génome de façon à contrôler avec précision la relation entre le phénotype et le génotype.
Les scientifiques ont donc rassemblé les courbes de l’élongation de 1500 cellules en condition contrôle et génétiquement perturbées pour représenter la variété des possibilités. Afin de réaliser une analyse sans a priori, ils ont basé leur approche uniquement sur les données. Les descripteurs de variabilité ont été automatiquement extraits. Avec cette méthode, ils ont obtenu deux descripteurs proches de ceux déjà connus : la longueur du fuseau et le taux d'élongation en anaphase (étape de la mitose ou les chromosomes atteignent le pôle du fuseau mitotique). Mais les scientifiques en ont découvert un nouveau : le raccourcissement en fin de métaphase (étape de la mitose où les chromosomes sont rassemblés au centre du fuseau) – présent dans toutes les conditions. Un tel phénotype était auparavant limité aux cellules avec des attachements de chromosomes défectueux.
Une analyse qui fait ressortir les mécanismes fondamentaux.
Ces trois descripteurs expliquent 95 % de la variabilité, ce qui suggère que la chorégraphie complexe du fuseau repose uniquement sur quelques mécanismes de base. Cela limite aussi les phénotypes possibles, pointant des mécanismes assurant la robustesse de la division.
De plus, les scientifiques ont montré que la longueur finale du fuseau en anaphase, importante pour déterminer le destin des cellules filles, est déjà fixée en fin de métaphase, malgré un réassemblage complet du fuseau entre les deux phases. Cela révèle une interdépendance inattendue des fuseaux métaphasiques et anaphasiques.
De plus, les mêmes descripteurs expliquent la variabilité dans les conditions génétiquement perturbées. Cela suggère qu'aucun nouveau mécanisme n’apparaît dans les cellules défectueuses. Seules les contributions des mécanismes changent.
Au final, ces résultats permettent de faire ressortir les principes mécanistiques fondamentaux régissant les fuseaux mitotiques et leur robustesse. Cela contribuera à identifier par quel mécanisme les cellules cancéreuses parviennent à se diviser malgré les défauts accumulés et malgré les traitements antimitotiques.
Au-delà de ces premiers résultats sur le fuseau mitotique, ces travaux offrent aussi un outil pratique de quantification des phénotypes dans d’autres contextes cellulaires. Via l’utilisation d’intelligence artificielle, cette méthode permettra de proposer de nouveaux gènes candidats impliqués dans les mécanismes de la division cellulaire. Elle est un enjeu important pour augmenter notre compréhension et identifier les acteurs de mécanismes, pour le cas échéant en faire de futures cibles thérapeutiques.
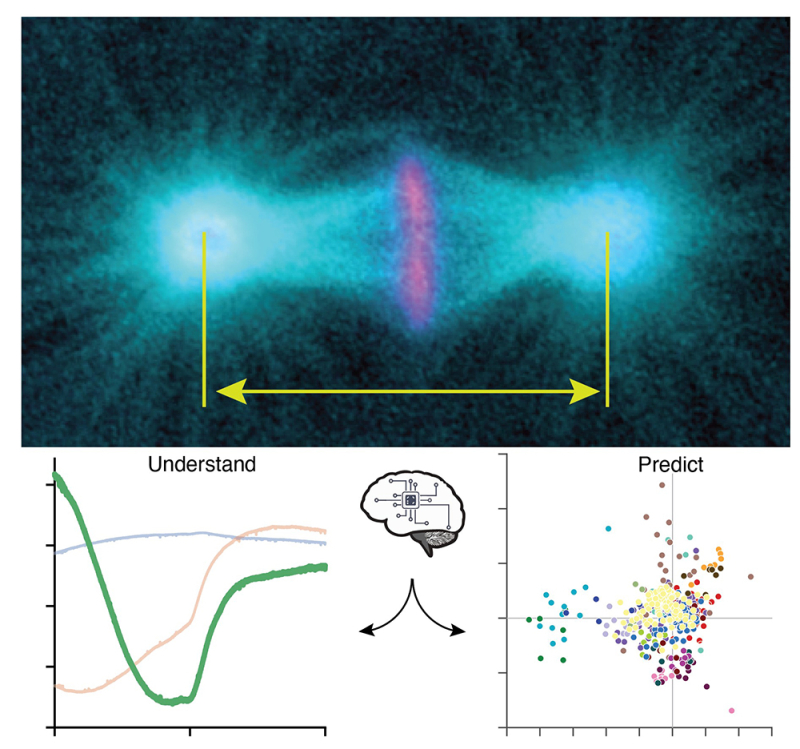
Figure : En haut, marquage des microtubules en cyan et des chromosomes en magenta ainsi que les pôles du fuseau mitotique dont les centrosomes, structures suivies dans nos analyses. L’image est prise en métaphase tardive. En bas à gauche, les trois archétypes, avec en plus visible le troisième archétype moins attendu. Ces archétypes représentent des élongations typiques du fuseau mitotique au cours du temps en métaphase et anaphase. À droite, une classification figurant le dosage de chaque archétype pour reproduire les élongations dans quelques conditions génétiquement perturbées. Chaque couleur correspond à un gène donné. Lorsque les points sont proches, cela suggère des phénotypes similaires et suggère des gènes appartenant potentiellement à la même voie de signalisation ou au même mécanisme.
En savoir plus : Le Cunff Y, Chesneau L, Pastezeur S,Pinson X, Soler N, Fairbrass D, et al. (2024). Unveiling inter-embryo variability in spindle length over time: Towards quantitative phenotype analysis. PLoS Comput Biol 20(9): e1012330. https://doi.org/10.1371/journal.pcbi.1012330
Contact
Laboratoire
Institut de génétique et développement de Rennes – IGDR (CNRS/Université de Rennes)
2 avenue du Professeur Léon Bernard
35043 Rennes cedex
