L’ADN maître de l’origami : un nouveau mécanisme d’héritage biologique
Dans un article publié dans Molecular Cell, des scientifiques ont découvert comment l’organisation tridimensionnelle de l’ADN dans nos cellules influence les gènes sur plusieurs générations. En manipulant, chez la drosophile, cette organisation de l’ADN sans modifier sa séquence, ils ont déclenché un changement qui se maintient pendant de nombreuses générations. Cette découverte révèle une nouvelle forme d’héritage, en complément de celle transmise par la séquence d’ADN.
Au-delà des gènes : l’organisation 3D de l’ADN influence leur expression.
Nous sommes habitués à l’idée que l’essentiel de ce que nous sommes réside dans nos gènes, que nous héritons à parts égales de chacun de nos deux parents. Cependant, les informations contenues dans la séquence de notre ADN ne racontent pas toute l’histoire. En complément de ce matériel génétique, les signaux dits « épigénétiques » jouent un rôle essentiel dans l’identité individuelle et se révèlent de plus en plus être une partie intégrante des informations transmises des parents à leur progéniture.
Le terme « Épigénétique » fait référence aux processus qui affectent l'expression des gènes sans modifier la séquence d'ADN et désigne le plus souvent un ensemble de modifications chimiques de l'ADN et des protéines associées qui activent ou désactivent les gènes. Un élément moins connu mais tout aussi crucial est l’organisation des gènes dans l’espace 3D au sein de la cellule. Les gènes désactivés, par exemple, peuvent se regrouper et former des groupes réprimés qui s’éteignent mutuellement. Ces contacts entre des régions de l’ADN qui seraient normalement éloignées signifient que même les gènes de différents chromosomes peuvent s’influencer mutuellement par le biais d’interactions physiques réelles.
Des mouches et des couleurs : une expérience qui révolutionne notre vision de l’héritage biologique.
Dans une nouvelle étude, publiée dans la revue Molecular Cell, des scientifiques ont démontré que les contacts physiques entre deux gènes de mouche déclenchent chez l'un d'eux un changement épigénétique pouvant être hérité d'une génération à l'autre. Cela entraîne un changement frappant dans l'apparence des mouches, qui ont des yeux rouges ou blancs et qui transmettent cette couleur des yeux à leur progéniture pendant de nombreuses générations.
De manière générale, le mécanisme qui génère de tels contacts est complexe et encore mal compris. Dans ce cas, les scientifiques ont pu démontrer qu’une protéine appelée GAF, qui se lie aux deux gènes, initie le processus d’héritage épigénétique. Une mutation de GAF a entraîné l’élimination de ces contacts, mettant en évidence son rôle clé dans le rapprochement de ces régions normalement éloignées du génome.
Bien que ces observations suggèrent que les contacts dirigés par GAF étaient l’événement clé conduisant à l’héritage de l’information épigénétique, cela ne constituait pas encore une preuve définitive. Pour y parvenir, les scientifiques ont recréé ces contacts artificiellement en concevant et en exprimant une protéine capable de se lier aux deux gènes d’intérêt (et uniquement à ces gènes). Cette protéine imitait ainsi le rôle de GAF en se liant aux deux gènes pour les relier entre eux. Forcer ces contacts de cette manière a produit le même effet qu’une augmentation naturelle des interactions et a conduit à l’héritage de la couleur des yeux sur plusieurs générations.
Cette expérience a démontré le rôle essentiel de l’organisation tridimensionnelle du génome dans ce processus, l’impliquant pour la première fois dans l’héritage de l’information épigénétique. Cette nouvelle publication propose un mécanisme inédit pour expliquer comment certains signaux épigénétiques, qui pourraient autrement se perdre entre les générations, peuvent devenir transmissibles. Cela pourrait contribuer, aux côtés de la génétique, aux informations que nous héritons de nos parents et que nous transmettons à nos enfants.
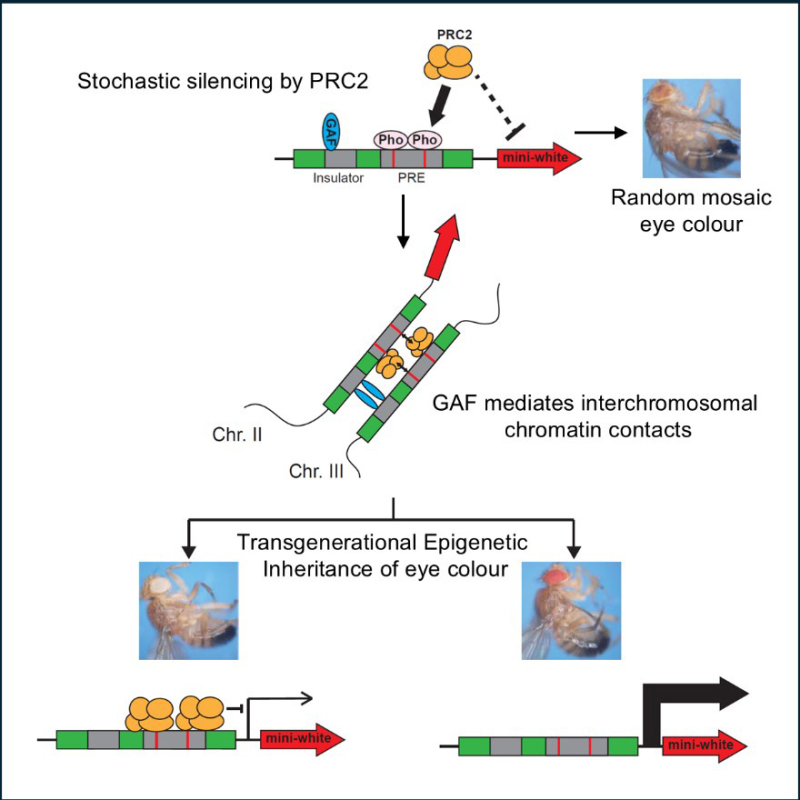
Figure : L’héritage d’informations non génétiques à travers les générations, un processus connu sous le nom d’héritage épigénétique transgénérationnel, a été étudié chez la drosophile. Dans cet organisme, l’hémizygotie de l’élément régulateur Fab-7 est capable de déclencher l’héritage de la marque histone H3K27me3 sur un locus homologue d’un autre chromosome, entraînant des différences épigénétiques héréditaires dans la couleur des yeux. Cet article met en évidence l’importance des protéines PHO et GAF dans l’établissement et le maintien de cet héritage transgénérationnel. Ces deux protéines jouent un rôle essentiel, respectivement, en recrutant le complexe répressif Polycomb 2 (PRC2) et en médiant les contacts chromatiniens interchromosomiques.
En outre, les scientifiques ont mis au point un système de biologie synthétique permettant d’induire des contacts chromatiniens in vivo. Ils ont démontré que ces contacts peuvent établir un héritage transgénérationnel, montrant ainsi que le simple contact entre deux loci peut induire une reprogrammation de l’expression génique héritable sur plusieurs générations.
Référence : Interchromosomal contacts between regulatory regions trigger stable transgenerational epigenetic inheritance in Drosophila. Fitz-James, M.H., Sabaris, G., Sarkies, P., Bantignies, F. & Cavalli, G. Molecular Cell (2024). DOI: 10.1016/j.molcel.2024.11.021
Contact
Laboratoire
Institut de Génétique Humaine - IGH (CNRS/Université de Montpellier)
141 Rue de la Cardonile
34090 Montpellier
