La fontaine de Jouvence sent le soufre
Gaz toxique, le sulfure d’hydrogène (H2S) est aussi une molécule de signalisation. Comprendre son mécanisme d’action requiert l’étude de la persulfidation des protéines, modification post-traductionnelle spécifique jusque-là difficilement traçable. Dans l’étude publiée dans Cell Metabolism, les chercheurs partagent une méthode chimio-sélective universelle de marquage qui a permis de faire la lumière sur les effets protecteurs des persulfides en réponse au stress oxydatif, et d’établir un lien prometteur entre persulfidation et vieillissement.
Gaz toxique et nauséabond, le sulfure d’hydrogène a récemment accédé au rang de gazotransmetteur. Produit de façon endogène par les cellules, le sulfure d’hydrogène agit comme molécule de signalisation redox associée à un panel d’effets physiologiques et pathologiques (cardiovasculaires, neuromodulateurs…) chez les mammifères. Le mécanisme sous-jacent proposé pour expliquer ses effets est la persulfidation (aussi connue sous le nom de S-sulfhydration), une modification oxydative spécifique des résidus cystéines qui module structure et fonction des protéines. Ce mécanisme aurait d’ailleurs évolué depuis l’émergence de la vie à l’époque où un environnement riche en sulfure d’hydrogène prévalait sur notre planète. En dépit du potentiel thérapeutique du sulfure d’hydrogène, la persulfidation des protéines est restée jusque-là sous-étudiée en raison de son instabilité et de sa réactivité chimique similaire à celle d’autres modifications de la cystéine, faisant d’elle une modification très difficile à marquer sélectivement.
Dans cet article, les auteurs ont développé une stratégie chimio-sélective de bioconjugaison des persulfides, baptisée méthode « Dimedone-switch », permettant le marquage sélectif, rapide et robuste des persulfides. Ils ont valorisé la portée générale de cette méthode en l’adaptant à nombre de techniques d’étude et d’analyse des protéines (détection sur gel, microscopie à fluorescence, analyse protéomique...).
Par la mise en œuvre inédite de la méthode « Dimedone-switch » sur des échantillons biologiques issus de divers organismes-modèles, ils ont parallèlement illustré la conservation de la persulfidation au cours de l’évolution et son contrôle par le sulfure d’hydrogène généré au travers des voies biochimiques de transsulfuration et du catabolisme de la cystéine.
Outre la persulfidation, la cystéine est aussi une cible de modifications post-traductionnelles relatives au stress oxydatif. Les auteurs proposent un mécanisme général dans lequel les cellules soumises à ce type de stress produisent en réponse aux premières séquences de modifications oxydatives des vagues de persulfidation contrecarrant l’hyper-oxydation irréversible des cystéines, préservant de ce fait les fonctions des protéines et donc minimisant in fine les effets des dommages cellulaires.
Finalement, dans le but de faire la lumière sur l’intérêt biologique de cette protection naturelle des persulfides, les auteurs mettent en évidence une corrélation directe entre la capacité à produire des persulfides et la résistance au stress oxydatif, ainsi qu’une diminution de la persulfidation allant de pair avec la longévité chez le nématode Caenorhabditis elegans (utilisé communément en laboratoire comme modèle d’étude du vieillissement), la souris, le rat et les cellules humaines. Ainsi, la persulfidation pourrait donc représenter une "parade anti-vieillissement".
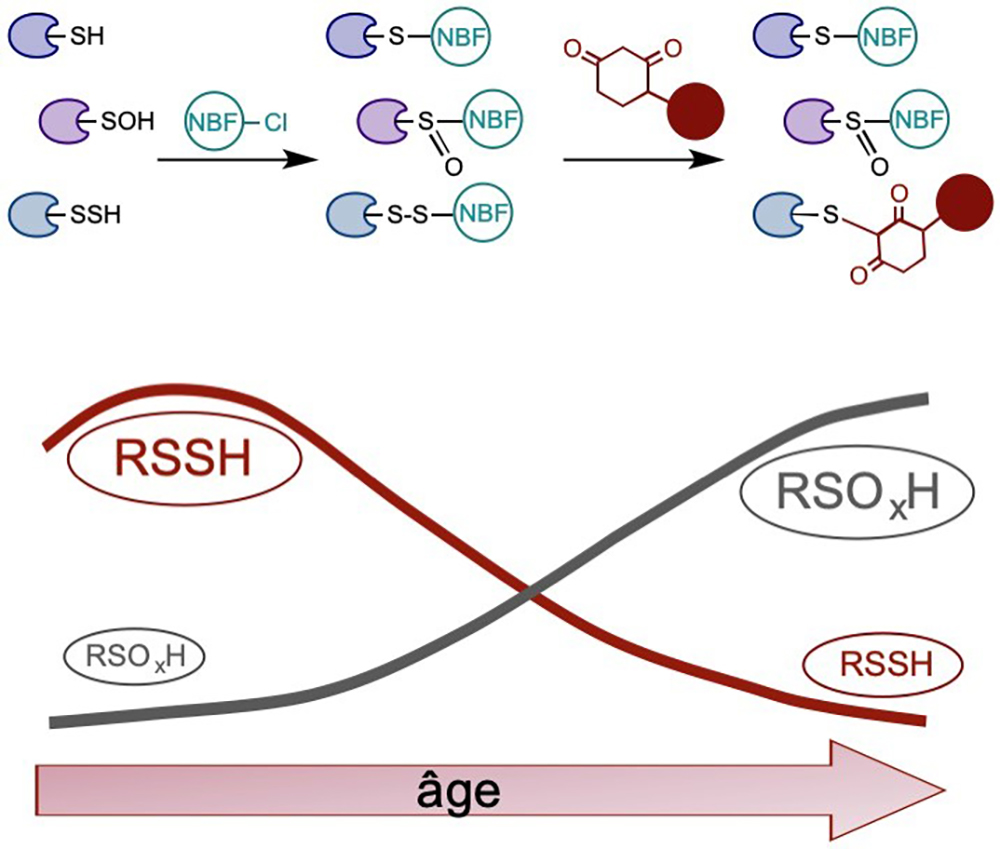
Figure : La méthode "Dimedone switch" pour le marquage des persulfides. La persulfidation (RSSH) décroit en function de l'âge tandis que l'hyperoxidation de la cystéine augmente. (NBF: nitrobenzofurazan)
Pour en savoir plus :
Selective Persulfide Detection Reveals Evolutionarily Conserved Antiaging Effects of S-Sulfhydration.
Zivanovic J, Kouroussis E, Kohl JB, Adhikari B, Bursac B, Schott-Roux S, Petrovic D, Miljkovic JL, Thomas-Lopez D, Jung Y, Miler M, Mitchell S, Milosevic V, Gomes JE, Benhar M, Gonzales-Zorn B, Ivanovic-Burmazovic I, Torregrossa R, Mitchell JR, Whiteman M, Schwarz G, Snyder SH, Paul BD, Carroll KS, Filipovic MR.
Cell Metab. 2019 Nov 13. pii: S1550-4131(19)30562-5. doi: 10.1016/j.cmet.2019.10.007. [Epub ahead of print]