La fibre de chromatine dans tous ses états !
Le destin de la cellule est déterminé par la structure et la dynamique de la chromatine, qui, mal connus, sont l'objet de débats scientifiques depuis 40 ans. Par une combinaison d’approches structurales et biochimiques, cette étude, publiée dans la revue Molecular Cell, a révélé la structure d’un filament de six nucléosomes, permettant de mieux comprendre la plasticité conformationnelle de la chromatine qui est au cœur de la régulation de l’expression des gènes.
L’information génétique chez les êtres vivants est portée par l’ADN, qui est emballé dans le noyau cellulaire sous forme de chromatine. L’élément de base de la chromatine est le nucléosome, formé par l’enroulement de l’ADN autour d’un cœur de protéines nommées histones. Les nucléosomes s’empilent les uns sur les autres pour constituer un filament nucléosomique, dont la structure est très dynamique. L’état conformationnel ou de compaction d’un filament nucléosomique joue un rôle crucial dans la détermination de l’expression des gènes. Notamment, la formation d’une fibre compacte de chromatine de 30 nm de diamètre est associée à l’inactivation de l’expression génétique. Cependant, la manière dont un filament nucléosomique se compacte ou se décondense reste encore mal comprise.
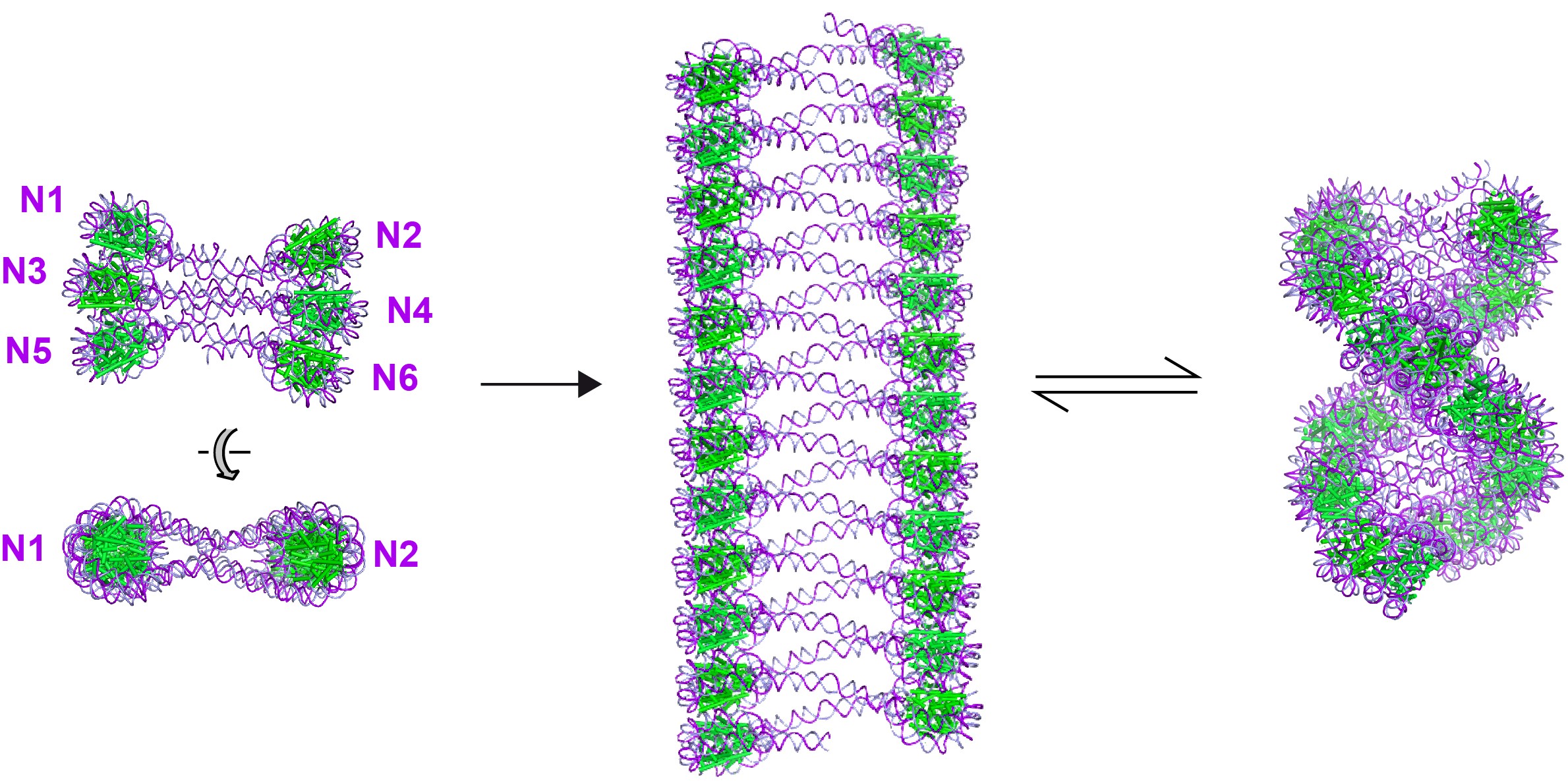
Un travail collaboratif entre quatre instituts de recherche français a déterminé la structure atomique d’un filament de six nucléosomes, dont la conformation 3D fournit des informations inédites sur la manière dont la chromatine peut changer d’état de condensation. En utilisant la cristallographie aux rayons X, les chercheurs ont trouvé que le filament nucléosomique pouvait former une superhélice étonnamment plate, dont la densité des nucléosomes est la moitié de celle de la fibre de chromatine de 30 nm. Par une série d’expériences biochimiques et biophysiques, ils ont confirmé que cette structure existait aussi en solution. De plus, en étudiant ce filament par cryo-microscopie électronique, ils ont découvert qu’un changement mineur de conditions ioniques pouvait induire la compaction et la torsion de la superhélice, permettant d’obtenir une structure correspondant à celle d’une fibre chromatinienne de 30 nm. Cela montre comment un changement subtil dans l’environnement local de la chromatine, pouvant survenir par exemple par interaction avec une protéine ou par des modifications post-traductionnelles des histones, peut induire un changement radical de conformation et d’état de compaction de la chromatine.
© Isabel Garcia-Saez & Carlo Petosa
vidéo
La structure cristalline d’un filament de six nucléosomes N1 à N6 (à gauche) a permis de modéliser une fibre de chromatine dans une conformation ouverte (au centre). Des analyses par cryo-microscopie électronique ont montré qu’un changement mineur de conditions ioniques pouvait induire une conformation hélicale compacte (à droite).
© Isabel Garcia-Saez & Carlo Petosa
Audiodescription
En savoir plus
Structure of an H1-Bound 6-Nucleosome Array Reveals an Untwisted Two-Start Chromatin Fiber Conformation.
Garcia-Saez I, Menoni H, Boopathi R, Shukla MS, Soueidan L, Noirclerc-Savoye M, Le Roy A, Skoufias DA, Bednar J, Hamiche A, Angelov D, Petosa C, Dimitrov S.
Mol Cell. 2018 Oct 22. pii: S1097-2765(18)30798-6. doi: 10.1016/j.molcel.2018.09.027.