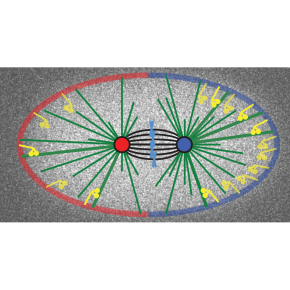
La chorégraphie du fuseau lors des divisions des cellules souches
La position correcte du fuseau lors d’une division cellulaire asymétrique, celle des cellules souches, assure le bon destin des cellules filles. Les microtubules astraux, filaments semi-flexibles très dynamiques, contribuent à générer les forces impliquées. Dans cet article publié dans la revue EMBO reports, les scientifiques ont mesuré les comportements individuels de ces filaments, déchiffrant les multiples régulations à l’œuvre. Pour cela, ils ont combiné expérimentations in vivo sur l’organisme modèle nématode et vision par ordinateur.
Lors des divisions asymétriques, il est essentiel de positionner le fuseau mitotique correctement, de manière décalée par rapport au centre de la cellule. Le fuseau joue le premier rôle durant la division cellulaire. Il permet la séparation des chromosomes grâce aux microtubules connectant les centrosomes situés aux pôles du fuseau et les chromosomes situés au milieu. De plus, sa position finale dicte celle du sillon initiant la cytocinèse, c’est-à-dire le partage du contenu de la cellule et de sa membrane. Dans le cas des cellules à caractère souche, qui sont polarisées, les deux cellules filles n’héritent pas des mêmes contenus et ont donc des destins différents. L’une garde un caractère souche et l’autre se différencie en tissu. Ce processus est très courant dans le règne animal, y compris chez l’homme. Cependant, un défaut de positionnement du fuseau fausse le destin cellulaire et conduit éventuellement à une prolifération anormale jusqu’au développement d’un cancer.
Les scientifiques utilisent un organisme modèle classique pour étudier la régulation de ce positionnement : l’embryon polarisé à une cellule du nématode Caenorhabditis elegans, un petit ver non pathogène et naturellement présent dans les sols de nos régions. Dans cette cellule, les pronoyaux ainsi que les centrosomes, et ensuite le fuseau, effectuent un ballet complexe. Ils se déplacent depuis l’extrémité postérieure de la cellule vers le centre pour ensuite retourner du côté postérieur. Cette chorégraphie très stéréotypée doit être respectée afin que la cellule fille postérieure garde un caractère souche (elle donnera en particulier la lignée germinale) alors que la cellule antérieure en se divisant conduira à la formation d’une partie des tissus du ver.
Les microtubules astraux (qui émanent des centrosomes pour rejoindre la périphérie de la cellule) sont très dynamiques, alternant élongation et raccourcissement. Ils génèrent des forces positionnant le fuseau, soit en poussant contre la périphérie de la cellule, soit en transmettant des forces de traction générées par le moteur moléculaire dynéine situé de manière transitoire à la périphérie cellulaire. Les acteurs de ces forces sont bien connus mais leur coordination reste incomprise.
Ces travaux proposent un triple contrôle des forces de traction, par la polarité, la position du fuseau elle-même et la progression temporelle au cours de la division, ces contrôles agissant indépendamment les uns des autres. La seule asymétrie antéro-postérieure du taux d’attachement de la dynéine au microtubule est suffisante pour provoquer le déplacement postérieur du fuseau, reflétant la polarité. Le contrôle positionnel ne renforce ce déséquilibre qu'en fin de séparation des chromatides soeurs (anaphase). Le contrôle temporel, pour sa part, est fonction de la durée de traction de la dynéine, qui augmente au cours de la division. Enfin, ces mesures suggèrent que les forces de poussée, constantes et symétriques durant la mitose, sont dominantes lorsque les chromosomes sont "à l'équateur" de la cellule (métaphase) et contribuent au maintien du fuseau au centre de la cellule. Au contraire, pendant l’anaphase, les forces de traction dominent et permettent le déplacement postérieur du fuseau.
Ces travaux combinent des approches innovantes d’analyse d’images par ordinateur et l'étude statistique des contacts des microtubules à la périphérie de la cellule, grâce à leur marquage fluorescent. Deux populations de contacts ont été mesurées en conditions physiologiques, révélant pour l’une la distribution des forces de traction, pour l’autre celle des forces de poussée. Ceci a été rendu possible par une approche résolument interdisciplinaire, depuis une innovation brevetée par le laboratoire dans le pilotage des microscopes jusqu’à la conception de logiciels d’analyse de la mécanique cellulaire basée sur les images.
Ces résultats montrent une robustesse de positionnement du fuseau mitotique qui émerge de réseaux d’acteurs dynamiques (microtubules, moteurs), capables de s’adapter aux forces générées et de sonder la position du fuseau. Ils suggèrent aussi que les divisions symétriques et asymétriques pourraient partager les mêmes mécanismes de positionnement du fuseau, plus ou moins dominants suivant le contexte cellulaire.
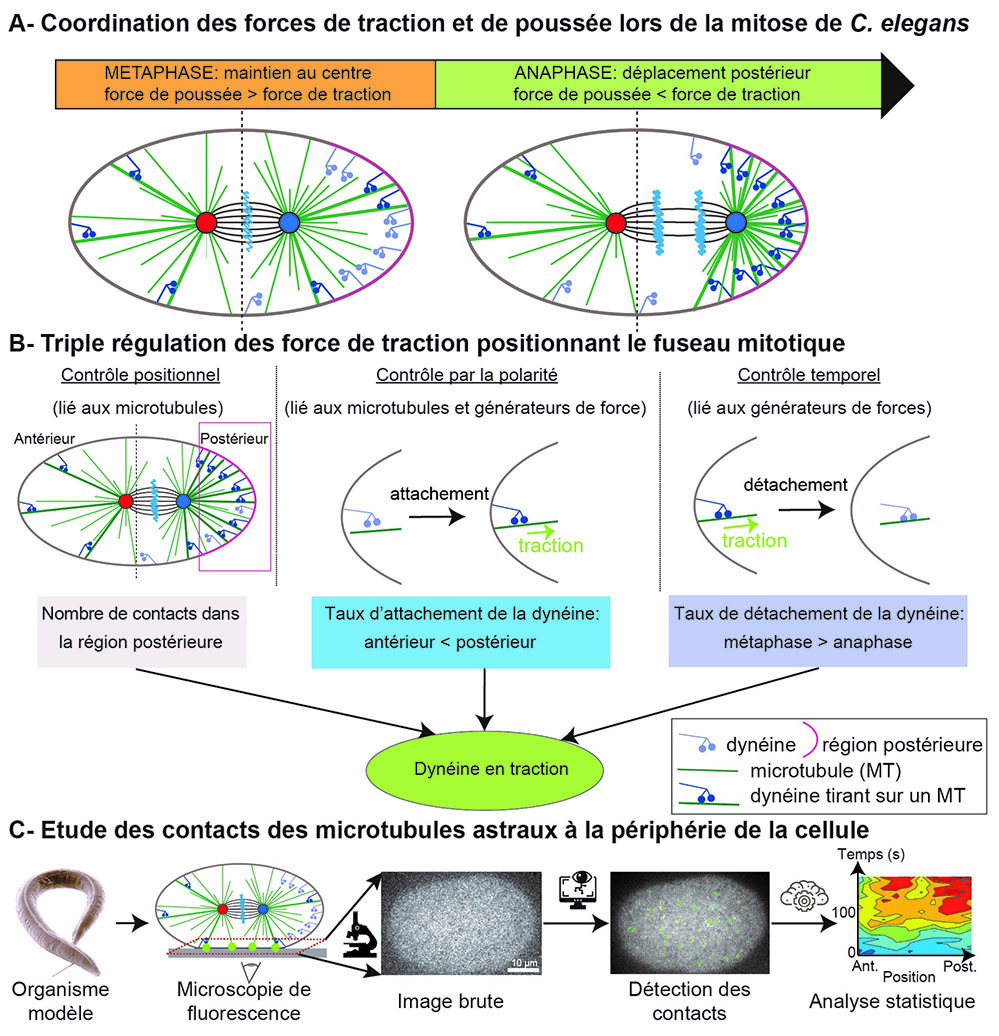
Figure :
(A) (Gauche) Les forces de poussée dominent en métaphase et maintiennent le fuseau au centre de la cellule. (Droite) Les forces de traction dominent en anaphase et conduisent au déplacement postérieur du fuseau.
(B) Les scientifiques ont démontré un triple contrôle des forces de traction qui positionnent le fuseau, grâce à trois mécanismes indépendants : (gauche) la position du fuseau dicte le nombre de contacts dans la région postérieure, créant une boucle de rétrocontrôle ; (milieu) la polarité régule les forces de traction en modulant le taux d’attachement des dynéines aux microtubules, celui-ci étant plus élevé du côté postérieur ; (droite) la progression mitotique régule les forces à travers le taux de détachement de la dynéine, c’est-à-dire la durée de traction sur le microtubule.
(C) (De gauche à droite) Les scientifiques ont utilisé l’organisme modèle nématode (Caenorhabditis elegans) duquel ils ont extrait les œufs. Ils ont alors imagé par microscopie de fluorescence l’embryon à une cellule après avoir marqué les microtubules en modifiant un gène correspondant pour le rendre fluorescent. Les images sont alors débruitées et les contacts des microtubules détectés par une analyse d’images adaptée. Une étude statistique de ces contacts mesurés permet de cartographier, le long de l’axe de l’embryon et au cours du temps, les contacts brefs révélant les forces de traction (carte d’illustration) et les contacts longs révélant les forces de poussée.
Pour en savoir plus :
The coordination of spindle-positioning forces during the asymmetric division of the C. elegans zygote.
Hélène Bouvrais, Laurent Chesneau, Yann Le Cunff, Danielle Fairbrass, Nina Soler, Sylvain Pastezeur, Thierry Pécot, Charles Kervrann, Jacques Pécréaux.
EMBO reports 26 avril 2021. https://doi.org/10.15252/embr.202050770
Contact
laboratoire
Institut de Génétique et Développement de Rennes (IGDR) - CNRS/Univ. Rennes 1
2 avenue du Professeur Léon Bernard
35043 Rennes Cedex