Infection chronique: où se cachent les bactéries pour résister aux antibiotiques ?
Les infections bactériennes chroniques sont particulièrement réfractaires aux traitements antibiotiques. Il est essentiel de développer de nouveaux modèles in vivo pour mieux comprendre et traiter les infections chroniques. Dans un article publié dans PLoS Pathogens, des scientifiques ont développé un nouveau modèle in vivo en utilisant l’embryon de poisson-zèbre. Ils ont montré que la bactérie Pseudomonas aeruginosa persiste sous forme d’amas dans les cellules de l’hôte, ouvrant ainsi de nouvelles pistes pour lutter contre la tolérance aux antibiotiques.
Les infections bactériennes chroniques ne répondent plus aux antibiotiques classiques
Les infections bactériennes restent une cause majeure de mortalité dans le monde, une situation aggravée par l’augmentation alarmante de l’antibiorésistance. Les infections bactériennes chroniques posent un problème clinique complexe, car elles échappent au système immunitaire et développent une résistance dite « adaptative » aux antibiotiques classiques. La bactérie Pseudomonas aeruginosa est largement connue pour causer des infections nosocomiales ainsi que des infections chroniques, notamment chez les patients atteints de mucoviscidose ou de plaies. Des modèles in vivo adaptés sont essentiels pour comprendre les mécanismes de cette résistance et développer des traitements efficaces.
Un nouveau modèle chez le poisson-zèbre pour visualiser les bactéries persistantes
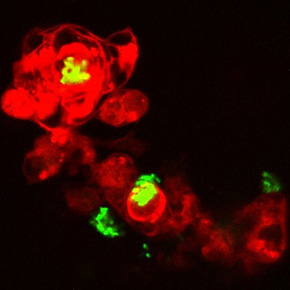
Dans un article publié dans la revue PLoS Pathogens, des scientifiques ont développé un nouveau modèle d’infection persistante chez un hôte vertébré, le poisson-zèbre (Danio rerio). En immergeant des embryons de poisson-zèbre blessés dans une suspension d’isolats cliniques de P. aeruginosa, ils ont reproduit une infection cutanée chronique similaire à celle observée chez la souris. Grâce à sa transparence, l’embryon de poisson-zèbre possède des atouts uniques pour visualiser en temps réel et à haute résolution les interactions hôte-bactéries. De plus, les scientifiques ont pu coupler l’imagerie sur le vivant avec la technique de microscopie électronique, qui permet d’imager en détail les organites cellulaires. L’étude a révélé que P. aeruginosa forme des agrégats persistants dans les cellules, notamment dans les macrophages, avec une résolution inédite. Alors que P. aeruginosa est considérée comme une bactérie principalement extracellulaire, pouvant former du biofilm, ces travaux soulignent l’importance d’une phase intracellulaire dans le processus de persistance.
Comment le modèle poisson-zèbre offre de nouvelles pistes pour rétablir l’efficacité de traitements antibiotiques contre l’infection chronique
Les bactéries P. aeruginosa persistantes dans l’embryon de poisson-zèbre résistent fortement à plusieurs antibiotiques classiques. Le phénomène de résistance adaptative aux antibiotiques est donc reproduit in vivo, chez un vertébré ayant une immunité innée proche de celle de l’Homme. L’analyse par microscopie révèle les mécanismes sous-jacents de cette résistance et propose des solutions pour surmonter l’échec des antibiotiques. En particulier, la niche intracellulaire semble protéger les bactéries de l’action des antibiotiques puisque l’antibiotique pénétrant le mieux dans les cellules de l’hôte s’avère être le plus efficace. De plus, l’activité d’antibiotiques classiques contre les bactéries persistantes peut être restaurée lors de l’ajout de molécules anti-biofilm qui dispersent les agrégats bactériens in vivo. Cette étude propose donc de nouvelles pistes et une méthodologie innovante pour traiter les infections chroniques.
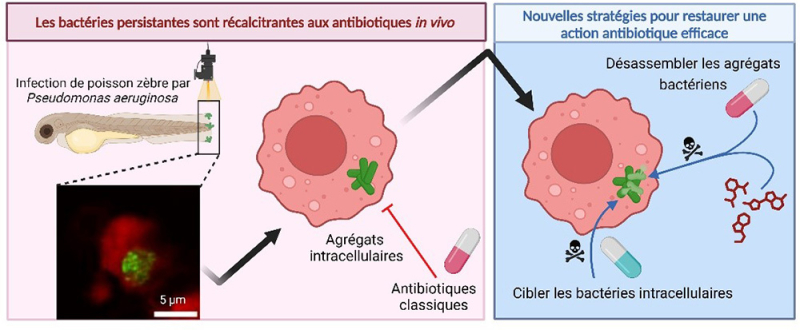
Figure : Un modèle in vivo d’infection bactérienne persistante permet de reproduire le phénomène de résistance adaptative aux antibiotiques et ouvre des pistes pour des traitements alternatifs efficaces. L’immersion d’embryon de poisson zèbre (blessé au niveau de la nageoire) dans un bain d’isolat clinique de P. aeruginosa permet une colonisation persistante de la plaie. La microscopie sur l’organisme infecté vivant permet de visualiser les bactéries persistantes (en vert) sous forme d’amas, souvent localisés dans les cellules, en particulier dans les macrophages (en rouge). Ces bactéries persistantes ne répondent plus au traitement par des antibiotiques classiques et l’analyse par microscopie guide vers de nouveaux traitements: des antibiotiques qui pénètrent mieux dans les cellules hôtes s’avèrent être les plus efficaces et des molécules qui dispersent les amas cellulaires (molécules anti-biofilm) peuvent rétablir l’action d’antibiotiques.
En savoir plus : Intracellular Pseudomonas aeruginosa persist and evade antibiotic treatment in a wound infection model
Pont S, Nilly F, Berry L, Bonhoure A, Alford MA, et al. (2025) Intracellular Pseudomonas aeruginosa persist and evade antibiotic treatment in a wound infection model. PLOS Pathogens 21(2): e1012922. https://doi.org/10.1371/journal.ppat.1012922
Contact
Laboratoire
Laboratory of pathogens and host immunity - LPHI (CNRS/Université de Montpellier)
Campus Triolet Bâtiment 24 CC107
Place Eugène Bataillon
34095 Montpellier