Illuminer l’inflammasome pour mieux comprendre l’inflammation
L’inflammasome est un complexe protéique qui, en réponse à la détection de motifs microbiens ou à des signaux de danger, conduit à une mort cellulaire programmée appelée pyroptose. Mais de nombreux autres mécanismes se mettent en place lors de la réponse immunitaire rendant difficile l’étude des réponses spécifiques induites par l’inflammasome. Dans un article publié dans la revue Science Signaling les scientifiques décrivent une méthode qui permet d’activer spécifiquement l’inflammasome par une simple stimulation lumineuse.
L’inflammation est le résultat de l’activation du système immunitaire inné en réponse à des pathogènes et des signaux de dangers. Il existe de nombreux senseurs impliqués dans la détection de ces agents qui activent des voies multiples dans les cellules.
Un outil qui permet d’activer spécifiquement l’inflammasome
Parmi ces multiples voies, l’activation de l’inflammasome induit la maturation des cytokines inflammatoires, l’interleukine-1béta (IL-1beta) et l’IL-18, et une mort inflammatoire appelée pyroptose due à la perforation des membranes par la protéine gasdermine-D. Cette dernière est caractérisée par le gonflement de la membrane suivie de la lyse de la cellule, conduisant au relargage de nombreuses molécules impliquées dans la signalisation de l’inflammation. Comprendre les mécanismes sous-jacents de la pyroptose notamment la coordination gonflement/lyse cellulaire restait un défi. Dans une étude publiée dans Science Signaling, les scientifiques décrivent et caractérisent un nouvel outil basé sur l’optogénétique. Il consiste à modifier génétiquement des macrophages de façon à ce que l’inflammasome puisse être activé spécifiquement par un signal lumineux. Cette technique permet de parfaitement contrôler et récapituler l’activation de l’inflammasome.
Un outil qui permet de décrypter les caractéristiques biologiques de la pyroptose
En introduisant cet outil dans des macrophages, les scientifiques ont pu quantifier de façon précise l’augmentation du volume cellulaire au cours de la pyroptose. Ainsi, ils décrivent un gonflement par palier et démontrent que la rupture membranaire associée à cette mort n’est pas le résultat d’un mécanisme passif lié à la tension membranaire mais celui d’un mécanisme actif et extrêmement régulé.
Grâce à ce nouvel outil, les chercheurs pourront étudier et modéliser les mécanismes physiques à l’œuvre sur la membrane plasmique au cours de la pyroptose. Ce travail ouvre la voie à de nouvelles possibilités en permettant de contrôler dynamiquement la réponse inflammatoire. Les connaissances obtenues permettront de développer des stratégies de modulation de l’action de l’inflammasome pour des applications thérapeutiques.
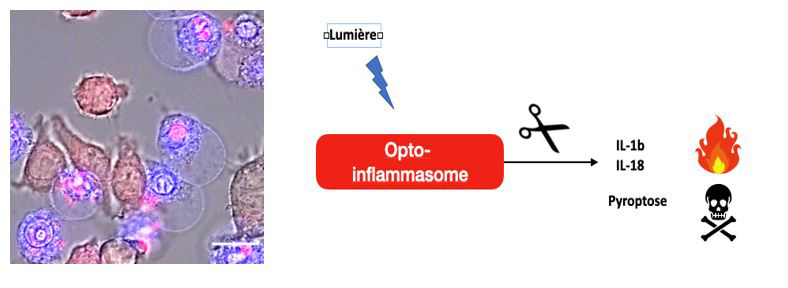
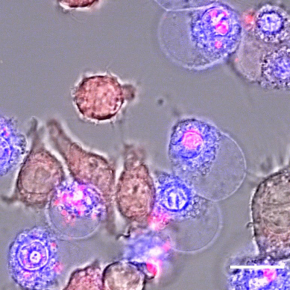
Figure : Image de microscopie confocale montrant des macrophages en pyroptose après activation par la lumière de l’inflammasome. L’inflammasome est couplé à la Red Fluorescent Protein (rouge) pour le visualiser. Il s’oligomérise après activation par la lumière, récapitulant une caractéristique physiologique. En conséquence la membrane plasmique gonfle et se perfore, laissant entrer un agent fluorescent intercalant de l’ADN (TOPRO-3 en bleu) permettant de visualiser les cellules mortes.
En savoir plus : Nadjar J, Monnier S, Bastien E, et al. Optogenetically controlled inflammasome activation demonstrates two phases of cell swelling during pyroptosis.Sci Signal. 2024
Contact
Laboratoire
Centre de recherche en cancérologie de Lyon - CRCL (Centre anticancéreux Léon Bérard/CNRS/Inserm/Université Claude Bernard)
28 rue Laennec
69008 Lyon