Garder le cap et maintenir la forme malgré les aléas développementaux
Comment les formes sont-elles sculptées de façon reproductible d’un individu à l’autre dans la nature est une question fascinante. Cet article paru dans la revue Developmental Cell souligne un rôle nouveau des forces mécaniques dans ce processus. Réussir à isoler mécaniquement une portion d’un tissu de façon à le rendre insensible aux perturbations présentes dans son environnement proche est un moyen pour une espèce vivante d’acquérir une architecture 3D stéréotypée.
Au cours du développement, les épithéliums subissent des remodelages hautement reproductibles pour passer d'une couche cellulaire en deux dimensions à une architecture tridimensionnelle formant les tissus et les organes : c'est la morphogenèse épithéliale. Tel un maestro qui coordonne ses musiciens pour que la symphonie soit jouée à la perfection, la morphogenèse est orchestrée selon une séquence d’évènements bien définie de façon à être robuste et stéréotypée. Cela commence par la mise en place d’une information de position suivant un programme génétique déterminé ; c’est le chef d’orchestre. Celui-ci coordonne ensuite des effecteurs tels que le cytosquelette d’acto-myosine dont dépendent les forces mécaniques. Ces forces, générées à l’échelle d’une cellule, peuvent ensuite se transmettre d’une cellule à une autre par les jonctions inter-cellulaires et in fine conduire à des modifications de forme tissulaire.
Toutefois, le cytosquelette d’acto-myosine et les forces mécaniques résultantes ne se bornent pas à exécuter un programme établi mais peuvent directement contrôler la robustesse de la morphogenèse indépendamment des informations de position établies par le patron développemental.
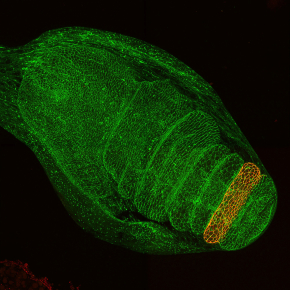
Pour aborder cette question de la robustesse, les chercheurs ont utilisé comme modèle la patte de drosophile. Ce tissu présente la particularité d’acquérir une forme très stéréotypée et bien caractérisée au cours du développement avec la formation de quatre plis strictement parallèles dans sa partie distale. En utilisant des approches génétiques, d’imagerie et de modélisation biophysique, les scientifiques ont montré que 1) malgré la mise en place correcte du patron développemental, la formation des plis devient très variable suite à l’inactivation du complexe Arp2/3, impliqué dans la formation d’un réseau branché d’actine, et affectant la localisation polarisée de l’acto-myosine, 2) la formation des plis est sans cesse affectée par des perturbations d’origine mécanique présentes dans l’environnement proche, et 3) la localisation préférentielle de l’acto-myosine sur les jonctions parallèles à l’axe de formation du pli (ou polarité planaire de l’acto-myosine) est essentielle pour canaliser et transmettre les forces selon cet axe et permettre une morphogenèse stéréotypée.
En résumé, les forces générées dans un tissu, tel un cheval qui serait facilement perturbé par le monde extérieur, ont besoin d’œillères pour ne pas se laisser influencer par leur environnement et rester canalisées dans une direction bien définie. Au sein du tissu, la polarité de la myosine joue ce rôle d’œillère permettant au tissu d’acquérir une forme reproductible.
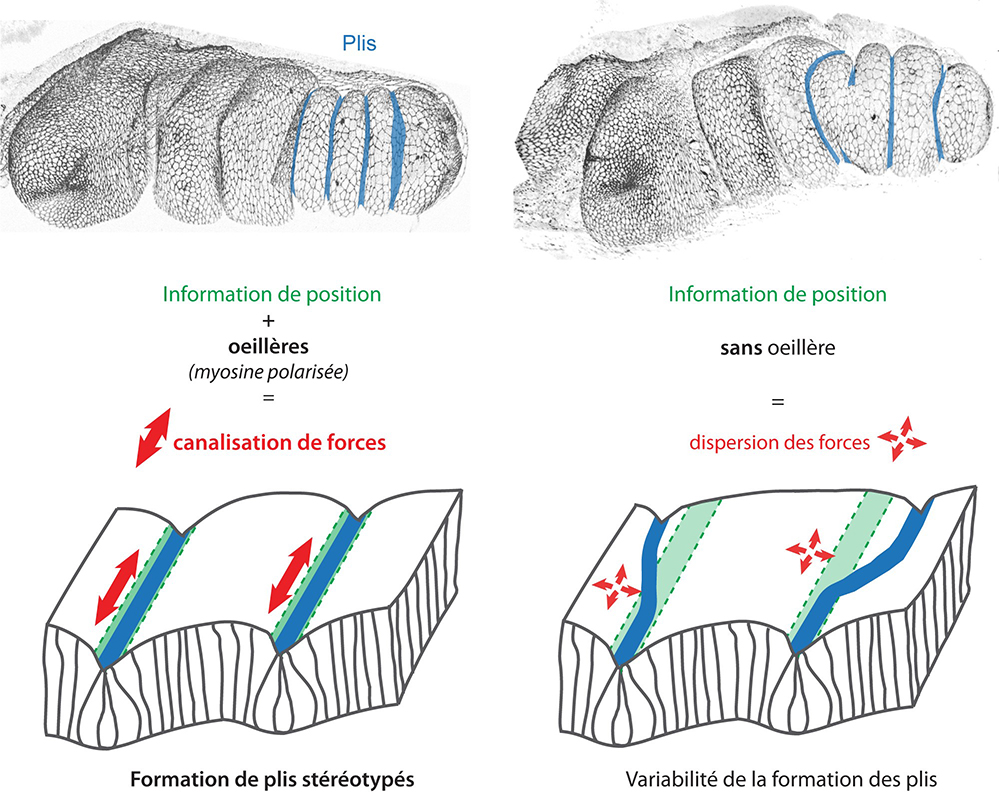
Figure : Haut : Reconstitution 3D d’une patte de drosophile en développement. Cette reconstitution imagée en microscopie confocale montre les jonctions intercellulaires et les 4 plis parallèles (en bleus) formés dans la partie distale de la patte. Bas : Schémas du rôle des œillères – la polarité planaire de l’acto-myosine – sur la formation des plis. Bien que l’information de position soit mise en place de façon correcte (région en vert), les forces (en rouge) doivent être canalisées pour que les plis (en bleu) se forment de façon reproductible. En absence de mécanisme de canalisation, la formation des plis devient variable.
Pour en savoir plus :
Arp2/3-dependent mechanical control of morphogenetic robustness in an inherently challenging environment
Martin E, Theis S, Gay G, Monier B, Rouvière C and Suzanne M
Dev Cell. 2 Février 2021. DOI: https://doi.org/10.1016/j.devcel.2021.01.005
Contact
Laboratoire
Centre de Biologie Intégrative (CBI) - (CNRS/Université Paul Sabatier)
169 Avenue Marianne Grunberg-Manago
31062 Toulouse Cedex 9