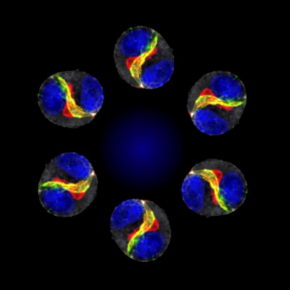
Faire danser les cellules pour comprendre l’organisation des tissus
Les interactions mécaniques entre cellules jouent un rôle majeur dans l’auto-organisation des tissus. Cependant leurs coordinations restent peu comprises en trois dimensions. Dans une étude publiée dans la revue Nature Physics, des scientifiques à l’aide d’un montage original de culture en trois dimensions, ont montré comment la brisure de symétrie des polarités cellulaires entraînent le mouvement, vérifiant ainsi le principe centenaire de Curie.
Les cellules se divisent, se déplacent, adhèrent. Ces dynamiques impliquent des interactions mécaniques complexes en trois dimensions. Si les acteurs majeurs sont identifiés à l’échelle moléculaire, les règles d’auto-organisation sont peu connues à ce jour. Cette limitation entraîne un besoin de mettre au point des systèmes simples pour déterminer les mécanismes majeurs qui dictent ces mouvements.
Dans cette étude, les scientifiques ont développé un montage expérimental qui a permis de montrer le mécanisme impliqué. Ils ont placé des couples de cellules épithéliales dans une matrice tridimensionnelle. Des agrégats de myosine, dans chacune des deux cellules, appliquent des contraintes locales sur la matrice extracellulaire et sur les jonctions adhérentes entre cellules entraînant leurs renforcements adhésifs locaux. Ces distributions génèrent des polarités cellulaires qui brisent la symétrie du doublet et entraînent sa rotation.
« Les éléments de symétrie des causes doivent se retrouver dans les effets produits »
Cette hypothèse a été sondée expérimentalement. Lorsque l’agrégat de myosine est supprimé localement par ablation laser, la rotation s’arrête. Si un agrégat est créé en activant localement l’activité de la GTPase Rho, le mouvement est modifié de manière prévisible. Les deux altérations expérimentales sont réversibles lorsque les agrégats reviennent dans leur position contrôle. Ces résultats montrent que les agrégats de myosine conduisent cette rotation. De manière frappante, la position des agrégats, les déformations de l’interface, et la rotation sont couplées de manière univoque.
Ces gradients de tension corticale ont été intégrés dans un modèle qui reproduit la rotation et les différentes expériences de manière quantitative. Pour aller plus loin, les chercheurs ont utilisé le principe de Curie de 1894 qui postule que « lorsque certaines causes produisent certains effets, les éléments de symétrie des causes doivent se retrouver dans les effets produits ». Cette règle est vérifiée pour le doublet avec les symétries de polarité cellulaire et les symétries de déformation des interfaces.
Ces résultats ouvrent des perspectives inédites pour comprendre les mouvements de cellules de manière générale. Ils pourraient permettre de prédire les dynamiques des tissus en trois dimensions dans des conditions variées.
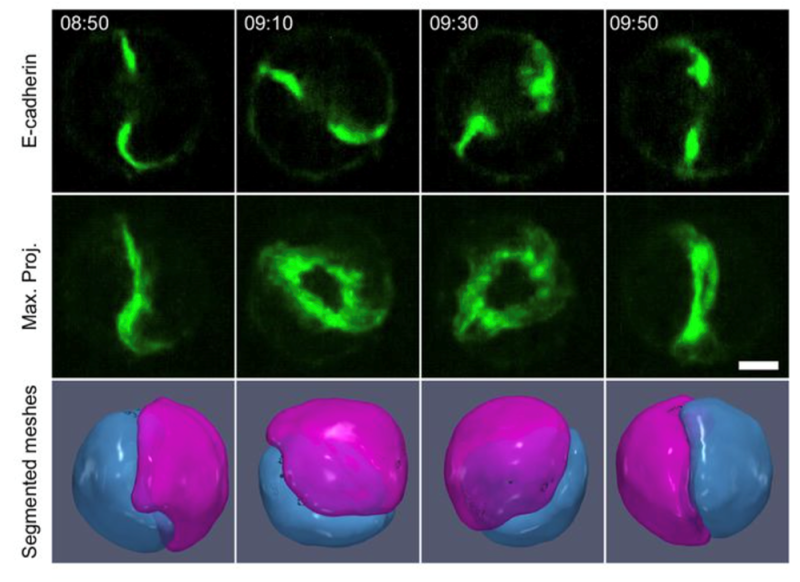
Figure : Rotation de doublets cellulaires, échelle 5mm.
En savoir plus : Lu et al. (2024). Polarity-driven three-dimensional spontaneous rotation of a cell doublet. Nature Physics.
Published online May 13, 2024. Polarity-driven three-dimensional spontaneous rotation of a cell doublet.
Laboratoire
Institut de génétique et de biologie moléculaire et cellulaire (CNRS/Inserm/Université de Strasbourg)
1 Rue Laurent Fries
67404 ILLKIRCH CEDEX - France