Eviter les translocations chromosomiques grâce à la sénataxine
Des anomalies de la protéine sénataxine sont impliquées dans deux syndromes neurologiques qui conduisent à une sclérose ou à une ataxie. La sénataxine est une hélicase qui est capable de dérouler des structures particulières de la chromatine : les hybrides ARN/ADN ou « R-loops ». Néanmoins, notre compréhension de la fonction de cette protéine et de son rôle dans les maladies reste limitée. L’équipe de Gaëlle Legube au Centre de biologie intégrative de Toulouse révèle que la sénataxine joue un rôle crucial dans la réponse aux cassures double-brin de l’ADN, en éliminant les R-loops générées et en évitant la formation de translocations chromosomiques et la mort cellulaire. Cette étude a été publiée le 7 février 2018 dans la revue Nature Communications.
C’est en 2004 que des mutations du gène SETX ont été identifiées dans deux maladies neurodégénératives héréditaires : la sclérose amyotrophique latérale de type 4 (ALS4) et l’ataxie avec apraxie oculomotrice de type 2 (AOA2). La protéine codée par ce gène, la sénataxine, est une hélicase qui joue un rôle dans la terminaison de la transcription et dans la réponse aux dommages oxydatifs de l’ADN. De plus, cette enzyme a été impliquée dans le déroulement des hybrides ARN/ADN au niveau de boucles particulières de la chromatine appelées « R-loops ». Ces structures peuvent se former durant la transcription lorsque l’ARN naissant s’hybride au brin d’ADN matrice.
Les R-loops sont passées en quelques années du statut de structures « anecdotiques » à celui de régulateurs importants de l’architecture dynamique de la chromatine et de la transcription des gènes chez les mammifères. Toutefois, la formation de nombreuses R-loops sur des régions actives doit être finement régulée pour éviter que ces structures ne deviennent une source d’instabilité génomique. Malgré les récentes avancées scientifiques sur les rôles biologiques de la sénataxine et des hybrides ARN/ADN, il reste à découvrir comment cette protéine hélicase et les R-loops conduisent aux neuropathies.
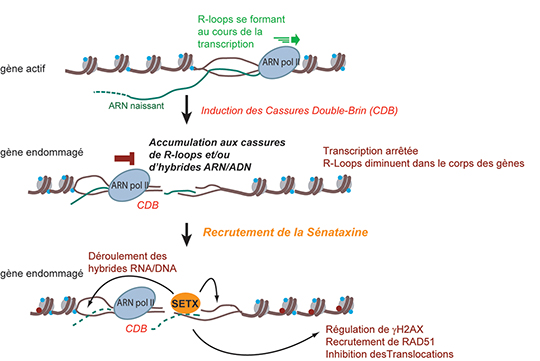
Puisque la sénataxine et les R-loops ont été reliées aux dommages de l’ADN, les chercheurs ont décidé d’étudier le rôle de cette protéine dans le système cellulaire DIvA qui permet l’induction simultanée de multiples cassures double-brin de l'ADN à des endroits annotés du génome. Grâce à des expériences d’immunoprécipitation de chromatine suivie de séquençage à haut débit (ChIP-seq), ils ont pu montrer que la sénataxine est recrutée spécifiquement aux sites des cassures de l’ADN lorsque celles-ci sont produites dans des gènes en cours de transcription.
Une collaboration avec l’équipe de Philippe Pasero à l’Institut de génétique humaine de Montpellier a permis de réaliser la cartographie globale de l’ensemble des R-loops du génome par une technique d’immunoprécipitation et séquencage des hybrides ARN/ADN (le DRIP-seq, qui utilise un anticorps reconnaissant spécifiquement ces structures, puis le séquençage global des régions immunoprécipitées correspondant aux hybrides ARN/ADN). Les résultats obtenus ont mis en évidence que les hybrides ARN/ADN diminuent dans le corps des gènes endommagés mais s’accumulent autour des cassures double-brin, excepté sur une région réduite au plus proche de la cassure qui coïncide précisément avec la présence de la sénataxine. La déplétion de cette hélicase conduit en effet à une augmentation locale de la formation des R-loops aux sites des cassures.
De plus, les chercheurs ont montré que, suite aux cassures double-brin survenant dans des gènes actifs, la sénataxine régule la signalisation des dommages, via l’histone gH2AX (connue pour s’y fixer préférentiellement), et participe au choix de la voie de réparation par recombinaison homologue, en induisant le recrutement de la recombinase RAD51. La sénataxine permet d’éviter la formation de réarrangements chromosomiques délétères, tels que les translocations, et contribue ainsi à la survie cellulaire.
L’ensemble de ces résultats révèle que la sénataxine joue un rôle crucial dans la réponse aux cassures double-brin de l’ADN et suggère que le déroulement des R-loops est nécessaire pour maintenir l’intégrité du génome. Il reste maintenant à comprendre pourquoi des mutations du gène SETX conduisent préférentiellement, pour l’instant, à ces deux syndromes neurologiques.
© Sarah Cohen, Nadine Puget et Gaëlle Legube
En savoir plus
-
Senataxin resolves RNA:DNA hybrids forming at DNA double-strand breaks to prevent translocations.
Cohen S, Puget N, Lin YL, Clouaire T, Aguirrebengoa M, Rocher V, Pasero P, Canitrot Y, Legube G.
Nat Commun. 2018 Feb 7;9(1):533. doi: 10.1038/s41467-018-02894-w.