Elucidation des mécanismes de coopération génétique à l’origine des tumeurs hépatiques
En collaboration avec l’Université du Minnesota et en utilisant une approche multidisciplinaire, les chercheurs ont identifié des mécanismes initiateurs du cancer du foie. Ils ont montré qu’une légère augmentation d’expression d’un récepteur sur la surface des cellules rendait les cellules du foie vulnérables à des altérations supplémentaires touchant une vaste catégorie de fonctions cellulaires, déclenchant ainsi la formation de tumeurs. Cette étude a été publiée dans la revue Journal of Hepatology.
On sait depuis longtemps que certaines protéines nécessaires à la communication entre les cellules, les récepteurs à activité tyrosine kinase (RTK), sont des régulateurs clés de plusieurs processus biologiques nécessaires au développement embryonnaire, ainsi qu’au bon fonctionnement des tissus adultes. La dérégulation de leur activation est responsable de plusieurs types de cancers. Ainsi, de nombreuses méthodes destinées à bloquer l’activité des RTKs ont été recherchées et certaines des molécules identifiées sont déjà utilisées en clinique pour des thérapies anticancéreuses. Par contre, on sait très peu de choses sur l’implication des RTKs dans les phases précoces de l’initiation des tumeurs et quels mécanismes sont mis en jeu.
Pour aborder cette question, les chercheurs ont fait appel à une stratégie multidisciplinaire. D’abord, ils ont utilisé un modèle de souris génétiquement modifiées présentant des niveaux d’expression élevés d’un RTK (le récepteur MET), dont ils avaient déjà montré qu’il prédispose les souris à développer un cancer du foie. Ce modèle a été combiné avec un système de mutagenèse appelé "Sleeping Beauty" (Belle au bois dormant). Comme son nom l’indique, ce système est basé sur des éléments d’ADN, appelés transposons, présents sous forme "dormante" dans le génome des souris. Les chercheurs sont capables de réveiller ces éléments dormants (grâce à un dispositif génétique) et de provoquer leur déplacement, les transposons s’intégrant alors de manière aléatoire dans d’autres positions du génome. Un tel déplacement peut conduire ces transposons à s’insérer soit dans des endroits sans importance, soit dans des gènes importants, dont ils vont perturber le fonctionnement. Lorsque le système Sleeping Beauty est combiné au modèle prédisposant au cancer du foie, il en résulte une forte accélération de l’apparition des tumeurs.
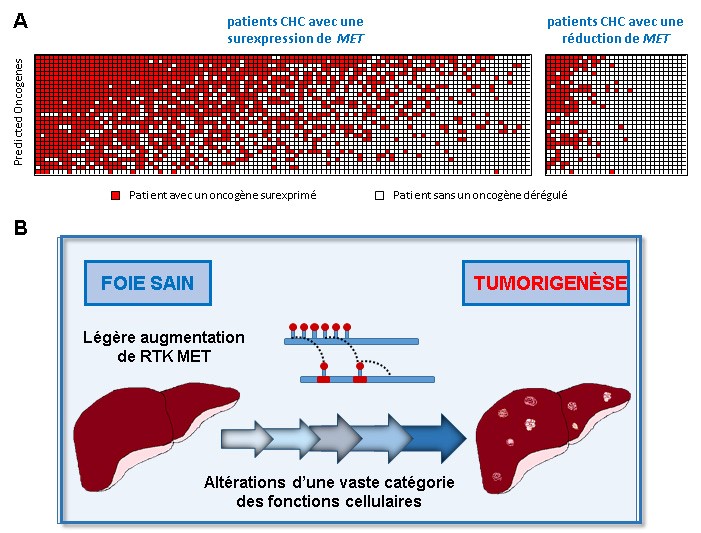
En séquençant le génome des tumeurs pour identifier les sites d’intégration des transposons, il est possible d’identifier quels gènes sont fréquemment altérés dans des tumeurs différentes (c’est-à-dire, les gènes dans lesquels le transposon s’est intégré dans plusieurs tumeurs indépendantes). Par ailleurs, le transposon a aussi été conçu pour permettre de prédire (dans une grande partie des cas), selon sa position et son sens d’insertion dans les gènes identifiés, s’ils fonctionnent dans le programme tumoral comme "facilitateurs" (lorsque l’insertion conduit à leur activation, on parle donc d’oncogènes ou comme "répresseurs" (lorsqu’ils sont inactivés par l’insertion du transposon, on parle de suppresseurs de tumeur). Parmi les gènes identifiés par les chercheurs, 99 ont été prédits comme suppresseurs de tumeur et 29 comme oncogènes. Pour les 143 gènes restants, le statut reste ambigu. L’ensemble des résultats amène à deux conclusions importantes.
1) En analysant les gènes identifiés dans des bases de données publiques des cancers, les chercheurs ont trouvé que la plupart des gènes identifiés grâce au modèle souris sont aussi dérégulés dans une proportion importante des patients atteints de carcinome hépatocellulaire (CHC). Par exemple, l’expression des gènes prédits comme étant des oncogènes est augmentée dans 10 à 50% des patients CHC. En plus, on observe chez les patients CHC une surprenante corrélation entre le niveau d’expression de ces oncogènes et le niveau d’expression de MET (dont l’élévation dans le modèle murin prédisposait au cancer). Ensemble, ces résultats montrent que plusieurs gènes altérés dans des tumeurs avancées de patients CHC sont vraisemblablement déjà impliqués dans les étapes les plus précoces du processus tumorigenèse.
2) La deuxième conclusion est liée aux fonctions cellulaires associées aux gènes identifiés. Une série d’analyses bio-informatiques a mis en évidence que les produits de ces gènes interviennent dans un grand nombre de processus cellulaires différents, comme la signalisation, le métabolisme, le remodelage de la chromatine, la dégradation de l'ARN, l’ubiquitination, la régulation du cycle cellulaire, et autres. Il semblerait donc qu’il y ait différents modes d'interaction avec les RTK lors de l’initiation du processus tumoral. Les chercheurs ont testé expérimentalement cette hypothèse en inactivant individuellement des gènes exerçant des fonctions biologiques différentes par une méthode dite d’interférence ARN (ShARN) qui diminue ou abolit leur expression. Ils ont ainsi montré que la réduction de l’expression d’une quinzaine de suppresseurs de tumeurs putatifs conférait des propriétés tumorales aux cellules, à condition que cette inactivation soit effectuée dans des cellules prédisposées au cancer par le modèle génétique d’élévation du niveau de RTK décrit précédemment.
L’ensemble de ces résultats illustre une capacité extraordinaire des RTKs à rendre les cellules du foie plus vulnérables à des altérations supplémentaires, et à coopérer avec plusieurs types d’altérations lors de l’initiation d’une tumeur hépatique. L’ensemble de ces résultats représente un saut conceptuel important dans la compréhension des interactions génétiques sous-jacentes à la coopération des gènes avec les RTKs lors de l'initiation d'une tumeur du foie.
© Flavio Maina
En savoir plus
-
Evaluating the landscape of gene cooperativity with RTKs in liver tumorigenesis using transposon-mediated mutagenesis.
Fan Y, Bazai S, Daian F, Arechederra M, Richelme S, Temiz NA, Yim A, Habermann BH, Dono R, Largaespada DA, Maina F.
J Hepatol. 2018 Dec 6. pii: S0168-8278(18)32578-9. doi: 10.1016/j.jhep.2018.11.027. PMID: 30529386.