Effets surprenants de certains anticorps neutralisant la protéine Spike du SARS-CoV-2
L’infection par le virus SARS-CoV-2 est initiée par la liaison de sa protéine de surface Spike au récepteur cellulaire ACE2, suivie de la fusion de la membrane virale avec celle cellulaire. Le développement d’anticorps neutralisant la protéine Spike, constitue ainsi une stratégie d’intérêt pour prévenir l’infection des cellules cibles du SARS-CoV-2. Les scientifiques ont criblé in vitro une banque d’anticorps bloquant de manière compétitive la liaison au récepteur ACE2 et en ont caractérisé des efficacités très divergentes de neutralisation contre le virus. Certains anticorps ont en effet démontré des propriétés stimulatrices de la fusion membranaire médiée par la protéine Spike, pouvant aller jusqu'à la formation de syncytia cellulaires, associée aux dommages tissulaires chroniques observés chez les patients COVID-19.
Le virus SARS-CoV-2 pénètre dans l’organisme via les voies aériennes, depuis le nez et la bouche. L’infection virale est initiée par la liaison de sa protéine de surface Spike (S) au récepteur cellulaire ACE2 exprimé à la surface des cellules qui tapissent nos voies respiratoires. Cette étape est ensuite suivie par des modifications conformationnelles de la protéine S qui va conduire au rapprochement de la membrane virale avec la membrane cellulaire et induire ainsi leur fusion mutuelle pour permettre au virus d’injecter son génome dans la cellule cible infectée et y démarrer son cycle réplicatif. De nouveaux virions vont ainsi se former et infecter de nouvelles cellules.
L’affinité de la liaison entre la protéine S et le récepteur ACE2 détermine le niveau de la réplication virale et la sévérité de la maladie. Bloquer la protéine S par des anticorps permet en théorie d’empêcher le virus de pénétrer dans les cellules et de s’y répliquer. En complément des vaccins, le développement d’anticorps thérapeutiques recombinant visant à neutraliser la protéine Spike constitue ainsi une stratégie d’immunothérapie d’intérêt pour prévenir l’infection par le virus SARS-CoV-2 des cellules cibles épithéliales respiratoires.
L’administration directe aux malades d’anticorps ciblant le SARS-CoV-2 (immunothérapie passive) a d’ailleurs été utilisée dès les premiers mois de la pandémie, à titre compassionnel, en administrant aux plus sévèrement atteints les anticorps produits naturellement par des patients guéris de la maladie. À ce jour, les conclusions des différentes études cliniques menées sont contrastées. En France l'ANSM-Agence nationale de sécurité du médicament et des produits de santé a autorisé l’utilisation en accès précoce d’anticorps monoclonaux, produits à partir de cellules immunitaires modifiées par génie génétique, dans un cadre sécurisé, pour traiter en bithérapie les patients adultes à risque de forme grave de la Covid-19 dès l'apparition des symptômes. Des essais cliniques sont en cours, avec des résultats préliminaires encourageants pour certains produits testés.
Dans ce contexte, les auteurs de l’étude ont criblé in vitro une banque d’anticorps ciblant le domaine RBD (Receptor Binding Domain) de la protéine S et bloquant de manière compétitive sa liaison au récepteur ACE2. Ils ont identifié des anticorps présentant des activités de neutralisation très divergentes contre le virus vivant, certains étant notamment très efficaces dans les modèles prédictifs d’infection in vitro basés sur des épithéliums respiratoires humains reconstitués d’origine nasale et cultivés en interface air/liquide. En revanche, d’autres anticorps spécifiques de la protéine S ont démontré des propriétés stimulant la fusion membranaire médiée par la protéine S et conduisant à la formation de syncytia (cellules fusionnées possédant donc plusieurs noyaux) dans des cellules Vero E6.
Des observations en cryo-microscopie électronique d’immuncomplexes ont révélé des modes distincts de liaison des anticorps à la protéine Spike, certains pouvant en stabiliser des conformations favorisant la formation de syncytia cellulaires. Cela pourrait compromettre l’activité de neutralisation virale dans le traitement des cas sévères de COVID-19 et accentuer les dommages tissulaires chroniques observés chez les patients. Les scientifiques ont ainsi identifié un anticorps thérapeutique potentiel qui inhibe la fusion cellulaire et la formation de syncytium et bloque également la liaison de la protéine Spike à son récepteur cellulaire. La cryo-microscopie électronique à haute résolution révèle que cet anticorps d’intérêt reconnait un épitope permettant la neutralisation de la protéine Spike dans sa forme de pré-fusion.
Outre le fait d’avoir caractérisé et validé un anticorps thérapeutique à très fort potentiel, les résultats de cette étude montrent qu'un travail de fond doit être mené dans l’élaboration des stratégies basées sur les anticorps neutralisants et notamment dans le choix des motifs antigéniques à cibler sur la protéine Spike du virus.
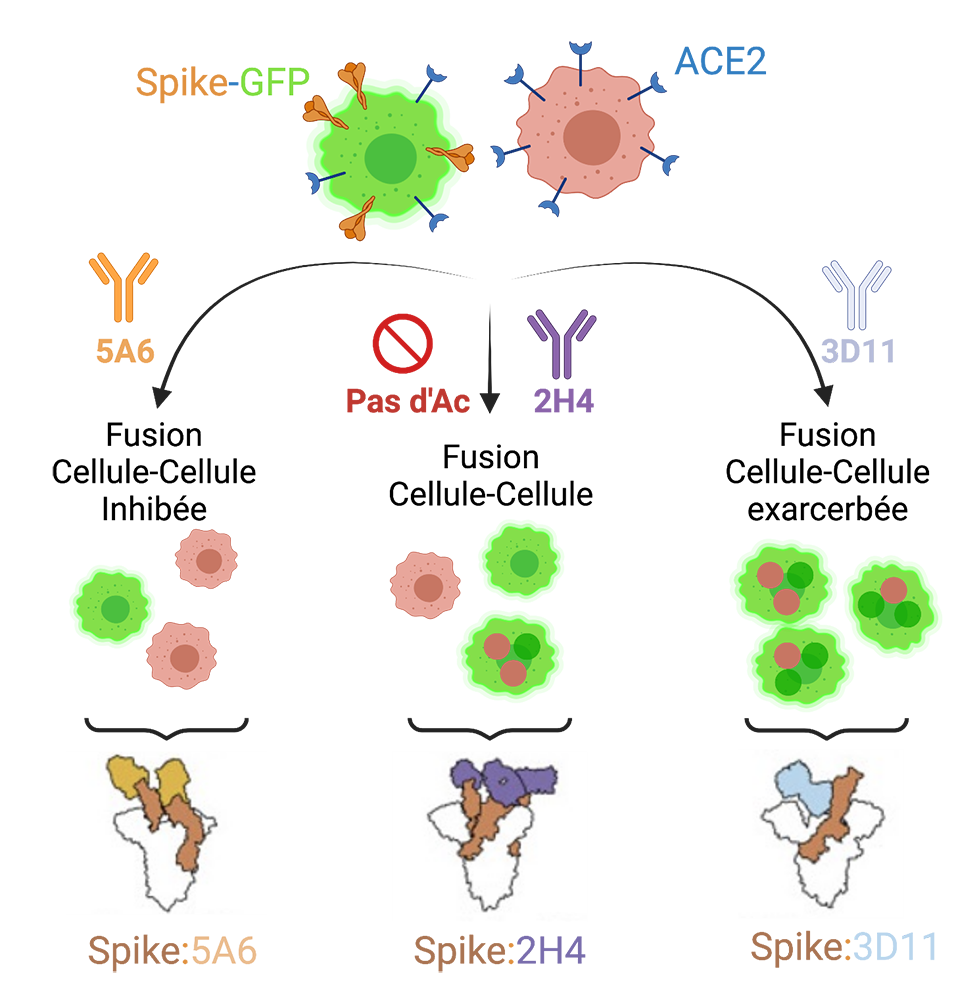
Figure : Les auteurs de l’étude ont criblé in vitro une banque d’anticorps ciblant le domaine RBD de la protéine Spike de SARS-CoV-2 et ont mis en évidence une série d'anticorps qui bloquent sa liaison avec le récepteur cellulaire ACE2, mais qui présentent des efficacités de neutralisation divergentes contre le virus vivant. De manière surprenante, ils ont observé que certains anticorps neutralisants peuvent soit inhiber (anticorps 5A6) soit renforcer (anticorps 3D11) la fusion membranaire médiée par la protéine Spike et la formation de syncytia. A l’aide de la cryo-microscopie électronique, l’étude des structures des complexes Spike-anticorps a mis en évidence des modes de liaison distincts qui non seulement bloquent la liaison au récepteur ACE2, mais modifient également la dynamique conformationnelle de la protéine Spike déclenchée par sa liaison au récepteur cellulaire. La stabilisation des différentes conformations de la Spike par les anticorps entraîne une modulation différencielle de la fusion membranaire médiée par la protéine Spike (figure réalisée à l’aide de Biorender).
Pour en savoir plus :
Structural insight into SARS-CoV-2 neutralizingantibodies and modulation of syncytia
Daniel Asarnow, Bei Wang, Hsin Lee, Yuanyu Hu, Ching-Wen Huang, Bryan Faust, Patricia Miang Lon Ng, Eve Zi Xian Ngoh, Markus Bohn, David Bulkley, Andre ́s Pizzorno, Beatrice Ary, Hwee Ching Tan, Chia Yin Lee, Rabiatul Adawiyah Minhat, Olivier Terrier, Mun Kuen Soh, Frannie Jiuyi Teo, Yvonne Yee Chin Yeap, Shirley Gek Kheng Seah, Conrad En Zuo Chan, Emily Connelly, Nicholas J. Young, Sebastian Maurer-Stroh, Laurent Renia, Brendon John Hanson, Manuel Rosa-Calatrava, Aashish Manglik, Yifan Cheng, Charles S. Craik and Cheng-I Wang
Cell Published:April 23, 2021 . https://doi.org/10.1016/j.cell.2021.04.033
Contact
laboratoire
Equipe VirPath au Centre International de Recherche en Infectiologie CIRI (Inserm/CNRS/ENS Lyon/UCBL1)
Faculté de Médecine RTH Laennec
7-11 rue Guillaume Paradin 69372 Lyon cedex 08
https://www.virpath.com/