Des plateformes de sécrétion de vésicules extracellulaires contrôlent l’apparition de métastases
Dans ces travaux publiés dans eLife, les chercheurs décrivent comment les cellules de cancer du sein fabriquent et relarguent de petites vésicules extracellulaires, les exosomes. Celles-ci se dispersent dans l’organisme et atteignent des organes distants pour favoriser l’apparition de métastases. Ils ont notamment mis en évidence deux protéines essentielles à la formation des exosomes tumoraux (RalA/B) et un récepteur (CD146) impliqué dans leur accumulation dans le futur organe métastatique.
Pour pouvoir se multiplier et envahir de nouveaux organes, les cellules cancéreuses ont besoin de contrôler leur environnement. Pour cela, un dialogue permanent s’engage entre cellules cancéreuses et cellules saines. Au cours des dernières années, plusieurs études ont montré que cette communication pouvait être relayée par de petites vésicules extracellulaires appelées exosomes. Les exosomes relargués par les cellules cancéreuses contiennent des messages moléculaires leur permettant de corrompre les cellules saines et de les mettre au service de la tumeur. Par ailleurs, ils modifient l’environnement proche de la tumeur, mais aussi celui d’organes distants, en empruntant la circulation sanguine. Ceci favorise ensuite l’arrivée de cellules cancéreuses et la formation de métastases, qui reste la cause de mortalité principale associée au cancer.
Dans cette étude, les chercheurs ont identifié deux nouveaux gènes, RalA et RalB (appelés ici RalA/B), impliqués dans le relargage des exosomes, pro-métastatiques, par les cellules cancéreuses. Une étude moléculaire et cellulaire leur a permis de montrer que RalA/B agissent sur l’homéostasie et la biogenèse des corps multi-vésiculaires, plateformes de formation et de sécrétion des exosomes. Ainsi, RalA/B contrôlent à la fois la quantité d’exosomes tumoraux sécrétés, mais aussi leur contenu et leurs propriétés pro-métastatiques. L’analyse du contenu de ces exosomes, a été combinée à des études fonctionnelles menées dans deux modèles animaux complémentaires, le poisson zèbre et la souris, indispensables à la compréhension de ces mécanismes complexes et systémiques. Elles ont permis d’identifier la protéine d’adhésion CD146 comme un acteur central régissant les propriétés prométastatiques des exosomes. L’expression de ces 3 molécules (RalA/B et CD146) est d’ailleurs un facteur de mauvais pronostic chez les patientes atteintes de cancer du sein. Cette étude permet ainsi de relier, pour la première fois, les mécanismes moléculaires de biogenèse des exosomes à leur potentiel prométastatique dans un contexte pertinent de cancer du sein métastatique.
Ces découvertes pourraient avoir d’importantes retombées aussi bien sur la compréhension des mécanismes de formation des vésicules extracellulaires, mais aussi en cancérologie où un regard particulier sur RalA/B, mais aussi CD146, au sein de la tumeur ou dans les vésicules extracellulaires (accessibles par prise de sang), permettrait de proposer de nouvelles approches diagnostiques, voire d’explorer de nouvelles voies thérapeutiques ciblant la communication entre les cellules cancéreuses et leur environnement sain pour contrecarrer la formation de métastases.
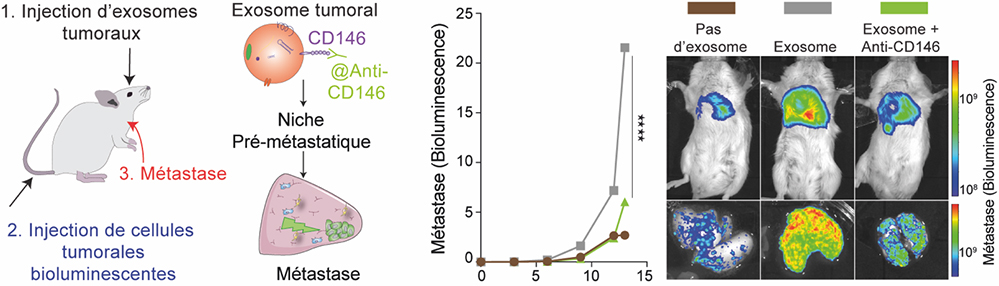
Figure : Dans cette expérience, des souris sont prétraitées avec des exosomes tumoraux (1), puis injectées avec des cellules tumorales bioluminescentes (2) qui permettent de suivre et de mesurer la progression métastatique (3). Le graphique central et les images de droite (bioluminescence dans la souris et dans les poumons) montrent que les exosomes tumoraux favorisent l’apparition de métastases. Cet effet est inhibé lorsque les exosomes sont traités avec un anticorps bloquant le récepteur CD146.
Pour en savoir plus :
Ral GTPases promote breast cancer metastasis by controlling biogenesis and organ targeting of exosomes.
Ghoroghi S, Mary B, Larnicol A, Asokan N, Klein A, Osmani N, Busnelli I, Delalande F, Paul N, Halary S, Gros F, Fouillen L, Haeberle AM, Royer C, Spiegelhalter C, André-Grégoire G, Mittelheisser V, Detappe A, Murphy K, Timpson P, Carapito R, Blot-Chabaud M, Gavard J, Carapito C, Vitale N, Lefebvre O, Goetz JG, Hyenne V.
Elife. 2021 Jan 6;10:e61539. doi: 10.7554/eLife.61539.
Contact
Laboratoire
Immuno rhumatologie moléculaire, groupe tumor biomechanics - (Inserm/Université de Strasbourg)
1, Rue Eugène Boeckel, 67084 Strasbourg Cedex