Des marques épigénétiques au service de la recombinaison méiotique
La recombinaison homologue est à l’origine d’échanges entre chromosomes lors de la méiose, division cellulaire spécialisée qui génère les gamètes haploïdes. Ces échanges ont lieu dans des régions du génome de taille restreinte, déterminées chez l’homme et la souris par les sites de fixation de la protéine PRDM9. Des chercheurs de l’Institut de génétique humaine ont publié le 22/02/2018 dans la revue Molecular Cell la mise en évidence du rôle essentiel de l’activité méthyl-transférase de PRDM9 dans la détermination des sites de recombinaison méiotique chez la souris.
Etape essentielle de la reproduction sexuée des eucaryotes, la méiose est la division cellulaire spécialisée qui permet, à partir d’une cellule diploïde (contenant deux lots chromosomiques complets), de générer les gamètes haploïdes (un seul lot chromosomique) utilisés lors de la fécondation. Le processus appelé recombinaison méiotique résulte de la formation programmée de cassures double-brin de l’ADN, qui sont réparées par recombinaison homologue. La formation d’un grand nombre de cassures double-brin de l’ADN (plusieurs centaines chez les mammifères) est un risque potentiel important pour la cellule.
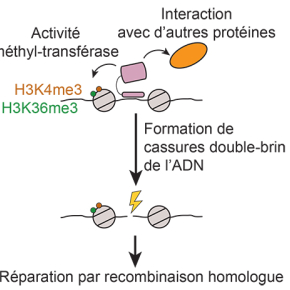
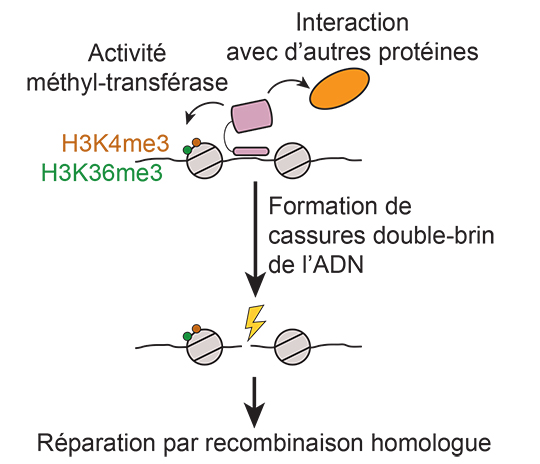
Les cassures double-brin méiotiques ont lieu préférentiellement dans des régions de taille restreinte appelées points chauds de recombinaison. Chez certains vertébrés dont l’homme et la souris, la position des points chauds de recombinaison est déterminée par la fixation d’une protéine, PRDM9, qui reconnait des séquences spécifiques d’ADN auxquelles elle se fixe. PRDM9 est une histone méthyl-transférase qui catalyse la triméthylation des lysines K4 et K36 de l’histone H3 (les histones sont des protéines associées à l’ADN en formant des nucléosomes qui structurent la chromatine) au niveau de ses sites de fixation, dans les cellules germinales au début de la méiose. Cependant, ces modifications d’histones sont également apposées par d’autres méthyl-transférases dans d’autres régions du génome, où il n’y a pas de recombinaison homologue. Leur présence n’est donc pas suffisante pour déterminer l’occurrence d’événements de recombinaison méiotique, et cela pose la question du rôle spécifique de PRDM9, en particulier de la contribution de son activité méthyl-transférase dans la ou les fonctions de cette protéine.
Pour répondre à cette question, les chercheurs ont généré un modèle de souris transgénique qui exprime une version mutante de la protéine PRDM9, dépourvue d’activité méthyl-transférase. Ils ont ainsi pu démontrer que PRDM9 a absolument besoin de son activité méthyl-transférase pour déterminer la position des sites de recombinaison méiotique dans le génome.
Ces données complètent la mise en évidence, par la même équipe, du rôle essentiel joué par un autre domaine de la protéine PRDM9, impliqué dans des interactions avec d’autres protéines. Ensemble, ces travaux suggèrent que PRDM9 permet de recruter la machinerie responsable de la formation des cassures double-brin en méiose en agissant de deux manières complémentaires : d’une part via des interactions spécifiques de PRDM9 avec d’autres protéines, d’autre part via la génération de modifications d’histone spécifiques (H3K4me3 et H3K36me3) grâce à son activité méthyl-transférase. En plus de permettre le ciblage des événements de recombinaison dans le génome, un tel mécanisme a le potentiel de favoriser la prise en charge des cassures double-brin formées pour leur réparation par recombinaison homologue.
© Frédéric Baudat et Bernard de Massy
En savoir plus
-
Diagouraga, B., Clément, J.A.J., Duret, L., Kadlec, J., de Massy, B. and Baudat, F. PRDM9 Methyltransferase Activity Is Essential for Meiotic DNA Double-Strand Break Formation at Its Binding Sites, Molecular Cell 2018 Fev 22 . https://doi.org/10.1016/j.molcel.2018.01.033