Des lymphocytes T transformés en laboratoire aident à mieux comprendre l’origine d’un lymphome de l’enfant.
Le lymphome anaplasique à grandes cellules est l’un des lymphomes T pédiatriques les plus fréquents. Il touche essentiellement les lymphocytes CD4, bras armés du système immunitaire, et est associé dans plus de 80% des cas à la translocation chromosomique du gène codant pour la protéine oncogénique ALK. Bien que la chimiothérapie soit très efficace, environ 30% des patients ne répondent pas au traitement ou rechutent en présentant alors une maladie plus sévère. Il est donc primordial de connaitre la genèse de ce cancer. En forçant des lymphocytes CD4 normaux à exprimer la protéine oncogénique provenant de cette translocation chromosomique NPM-ALK, les scientifiques ont réussi à modéliser en laboratoire le lymphome anaplasique à grandes cellules. Ce travail est publié dans le Journal of Clinical Investigation.
Les lymphomes représentent le 3ème cancer pédiatrique après les leucémies et les tumeurs du système nerveux central. Ils représentent 10% à 20% des tumeurs malignes de l’enfant. Ils sont classés en lymphome de Hodgkin et lymphomes non Hodgkiniens. Ces derniers sont les plus fréquents.
Le lymphome anaplasique à grandes cellules (LAGC) est un lymphome non-Hodgkinien à cellules T matures périphériques (à l’extérieur du thymus) rare (prévalence de 1à 9 pour 100.000) et agressif. Il a été pour la première fois décrit sur biopsies ganglionnaires en 1985. Les patients présentent souvent des symptômes généraux (fièvre, perte de poids, sueurs nocturnes). Les organes souvent atteints en dehors des ganglions sont la peau, le poumon, les tissus mous (les muscles, les tissus sous-cutanés…), le foie ou la moelle osseuse.
En 1994, un récepteur à activité tyrosine kinase, Anaplastic Lymphoma Kinase (ALK), a été identifié dans des lymphomes anaplasiques à grandes cellules (LAGC) associés à la translocation chromosomique (transfert d'un segment de chromosome à un autre chromosome) t(2;5)(p23;q35), qui s’est avérée par la suite la plus fréquente (85% des cas sont ainsi NPM-ALK positifs). En 1999, les chercheurs identifient une autre translocation oncogénique impliquant le gène ALK fusionné à un autre partenaire que NPM, le gène TPM3. Il s’agit de la seconde anomalie la plus fréquente (18% des cas). En 2000, l’expression de la protéine ALK est décrite dans un autre cancer pédiatrique, le neuroblastome.
Le LAGC comprend deux sous-types, selon l'expression de la protéine ALK : le LAGC ALK positif et le LAGC ALK négatif. Le sous-type ALK négatif est retrouvé plus souvent chez les patients plus âgés, à partir de l'âge de 40 ans. Le sous-type ALK positif affecte généralement les enfants et les jeunes adultes. Ainsi, le LAGC compte pour environ 3% des lymphomes non-hodgkiniens de l'adulte et pour 10 à 20% des lymphomes de l'enfant ce qui en fait le lymphome T pédiatrique le plus fréquent avec une incidence annuelle allant de 1,2 par million chez les enfants de moins de 15 ans, à environ 2 par million chez les jeunes adultes entre 25 et 34 ans, soit environ 80 nouveaux enfants cas diagnostiqués en Europe chaque année. Il est plus fréquent chez les garçons.
Du fait des rechutes fréquentes des LAGC, il est crucial d’identifier et de comprendre les mécanismes moléculaires qui, dictés par l’oncogène ALK, favorisent le développement et l’agressivité tumorale. Pour modéliser au mieux le LAGC, à partir de sang de donneurs sains, les chercheurs ont isolé puis infecté des lymphocytes T matures CD4+ avec une construction lentivirale permettant l’expression de NPM-ALK (oncoprotéine la plus fréquente). Des lignées cellulaires à la fois CD4 et ALK positives (+)) immortalisées et transformées ont été établies. En effet, leur croissance est dépendante de l’expression de l’oncogène ALK et ces cellules ont la capacité, dans des modèles murins, d’induire in vivo à la fois des tumeurs (au site d’injection) et des métastases, semblables tant au plan morphologique, phénotypique que génotypique aux cellules tumorales de patients atteints de LAGC. Il s‘agit là du premier modèle cellulaire mimant in vivo le LAGC.
Une étude associant l’exploration complète du méthylome sur génome entier par la technologie d’hybridation sur puce et un séquençage à haut débit des ARN totaux a été réalisée. Les données obtenues ont été comparées aux données de populations cellulaires T normales humaines triées issues du thymu, de populations normales souches triées issues de la moelle osseuse et aux données du transcriptome de patients obtenus à partir de la plus grande cohorte européenne. L’analyse bioinformatique de toutes ces données a révélé que dans les modèles cellulaires générés, les cellules CD4 tumorales ALK positives tout comme les cellules tumorales ALK positives des patients acquièrent sous le contrôle de ALK des caractéristiques de cellules souches cancéreuses d’origine thymique. Il s’agit notamment de l’expression de plusieurs régulateurs clés de la pluripotence (Oct4, Sox2 et NANOG) et l’expression la protéine HIF2α, jouant un rôle majeur dans la maintenance du phénotype souche des cellules hématopoïétiques cancéreuses.
Ce nouveau modèle cellulaire de lymphocytes T matures transformés en laboratoire par l’oncogène ALK qui se dédifférencient vers des cellules souches, ouvre des perspectives pour l’étude des mécanismes moléculaires à l’origine des rechutes après chimiothérapie ou thérapie ciblée anti-ALK.
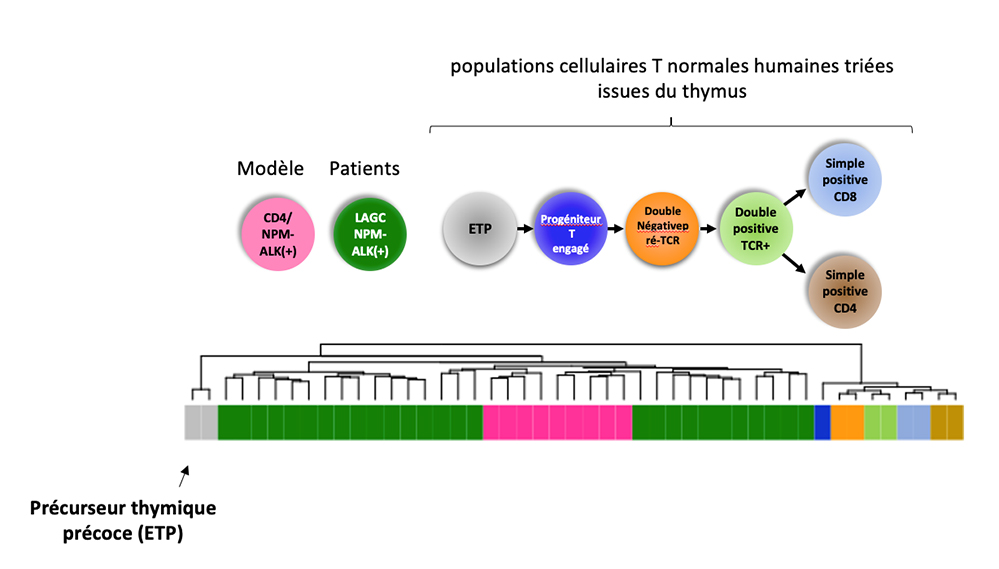
Figure : Par comparaisons à des populations cellulaires T normales humaines triées issues du thymus, l’analyse bio-informatique, du génome entier de lignées cellulaires malignes établies à partir de lymphocytes T matures CD4 isolés de sang de donneurs sains puis infectés avec une construction lentivirale codant l’oncoprotéine NPM-ALK révèle que dans les modèles cellulaires générés, les cellules CD4 tumorales ALK positives tout comme les cellules tumorales ALK positives des patients acquièrent des caractéristiques de précurseurs thymique précoce (ETP).
Pour en savoir plus :
ALK-transformed mature T lymphocytes restore early thymus progenitor features.
Congras A, Hoareau-Aveilla C, Caillet N, Tosolini M, Villarese P, Cieslak A, Rodriguez L, Asnafi V, Macintyre E, Egger G, Brousset P, Lamant L, Meggetto F.
J Clin Invest. 2020 Nov 3:134990. doi: 10.1172/JCI134990.
L'équipe de travail : https://www.crct-inserm.fr/07-p-brousset/
Contact
Laboratoire
Centre de Recherche en Cancérologie (CRCT) - (CNRS/Inserm/Université Toulouse Paul Sabatier)
F-31024. Toulouse, France