Des fonctions inattendues pour la dystrophine, impliquée dans la myopathie de Duchenne.
Chez l’Homme le gène de la dystrophine est tristement célèbre car sa mutation est responsable des myopathies de Duchenne et de Beker. En collaboration avec une équipe de Chicago, les scientifiques ont étudié le rôle de cette dystrophine dans des cellules non musculaires de drosophile. Ces résultats, publiés dans la revue Development, éclairent d’un jour nouveau ce que peuvent être les fonctions de la dystrophine à une échelle moléculaire et cellulaire et ouvrent des perspectives intéressantes pour mieux comprendre son implication dans les myopathies.
Le monde du vivant arbore une infinie diversité de formes à l’échelle des organismes entiers et cette diversité participe à notre émerveillement pour la nature. Néanmoins, l’existence de cette diversité ne repose pas sur des critères esthétiques mais bien sur des contraintes fonctionnelles. Il en va ainsi du cou de la girafe, pour atteindre les feuilles les plus hautes. La même diversité de formes, reposant sur les mêmes contraintes fonctionnelles, existe aussi à l’échelle de nos organes. Par exemple, l’arborescence de nos poumons maximise la surface d’échange entre l’air et le sang pour faciliter les échanges gazeux. Il est donc important de comprendre comment nos gènes sculptent ces organes en une forme spécifique (morphogenèse).
Les scientifiques ont utilisé les cellules folliculaires des ovaires de drosophile comme modèle d’épithélium in vivo. Cet épithélium possède une morphologie très similaire aux épithéliums de mammifères. Anatomiquement, il entoure la lignée de cellules germinales au sein de l’organe reproducteur, l’ensemble des cellules folliculaires et germinales constituant le follicule ovarien, précurseur du futur œuf. L’élongation du follicule ovarien, qui passe progressivement au cours de sa maturation d’une forme sphérique à une forme allongée, est engendrée par l’épithélium folliculaire et constitue donc un bon modèle pour comprendre le rôle de la matrice extracellulaire dans la morphogenèse.
Le gène codant la protéine dystrophine est muté dans les myopathies de Duchenne et de Beker, maladies dégénératives à la fois fréquentes et extrêmement graves. La dystrophine est une protéine géante qui relie le cytosquelette d’actine au dystroglycane, protéine transmembranaire qui se lie à la matrice extracellulaire. Il est couramment proposé que la principale fonction de la dystrophine est d’assurer une cohésion mécanique entre le cytosquelette des cellules et la matrice et que son absence expliquerait la dégénérescence des muscles induites par les contractions.
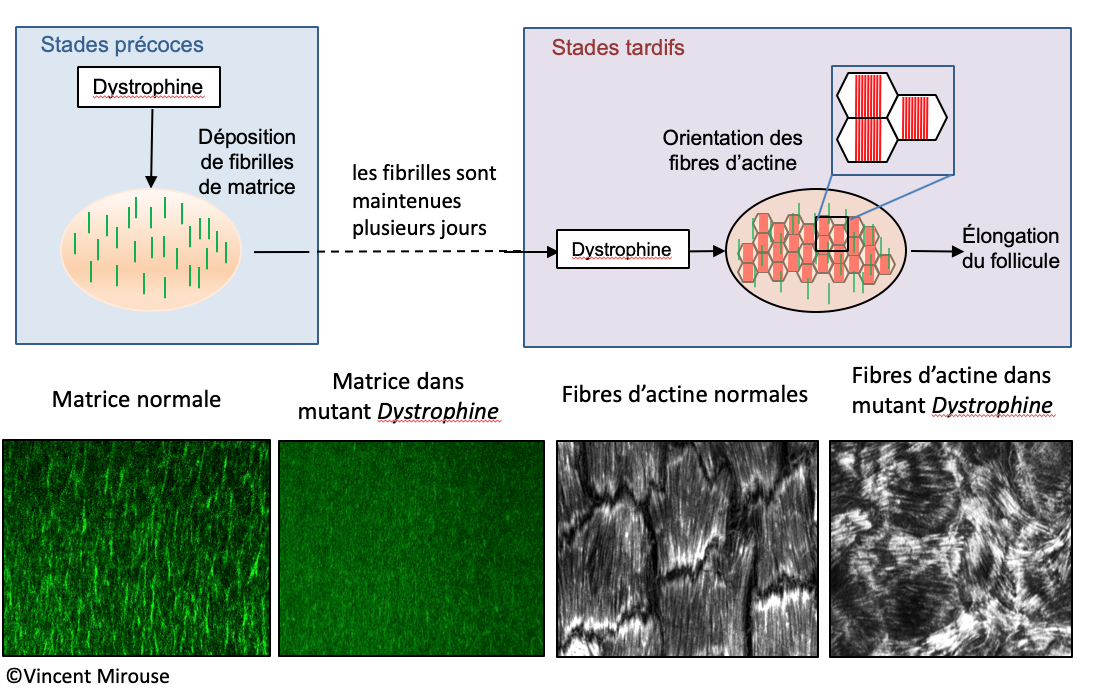
Les chercheurs ont montré chez la drosophile que la dystrophine possédait des fonctions plus complexes lors de l’élongation du follicule ovarien. D'une part, elle est nécessaire à l’organisation correcte de la matrice extracellulaire et plus particulièrement à la formation de fibrilles orientées perpendiculairement à l’axe d’élongation ce qui révèle un nouveau rôle dans le ciblage de la sécrétion des protéines qui constituent ces fibrilles. D’autre part, plus tard au cours du développement du follicule, la dystrophine est aussi requise pour orienter des fibres d’actine de manière identique dans toutes les cellules. Ces fibres d’actine forment un corset moléculaire qui contraint la croissance du follicule dans un axe et provoque donc son élongation dans l’autre axe. De plus, nous avons montré que les fibrilles de matrice orientées servaient de guide pour l’orientation des fibres d’actine.
Ces résultats obtenus en collaboration avec l’Université de Chicago montrent donc que la dystrophine n’agit comme une simple "colle" entre le cytosquelette d’actine et la matrice extracellulaire mais comme un organisateur de l’interface cellule/matrice. La mise en évidence de ces fonctions organisatrices dans le contexte de l’élongation du follicule ovarien pourrait permettre de mieux comprendre son rôle dans les cellules musculaires et son implication dans les myopathies.
Pour en savoir plus :
Oriented basement membrane fibrils provide a memory for F-actin planar polarization via the Dystrophin-Dystroglycan complex during tissue elongation.
Cerqueira Campos F, Dennis, Alégot H, Fritsch C, Isabella A, Pouchin P, Bardot, Horne-Badovinac S, Mirouse V.
Development 11 mars 2020 . doi: 10.1242/dev.186957
Contact
Laboratoire
Institut de Génétique Reproduction et Développement (iGReD) - (CNRS/INSERM/Université Clermont Auvergne)
28 place Henri-Dunand BP 38-63000 Clermont-Ferrand