Des défauts de l’expression des gènes dans la maladie des enfants de la lune
Les enfants de la lune ne peuvent s’exposer au soleil en raison de leur déficience dans des protéines de la réparation de l’ADN dont XPC, le facteur qui reconnaît les lésions dues aux rayons ultraviolets. Un défaut de réparation de l’ADN ne suffit pourtant pas à expliquer l’ensemble des symptômes observés. Dans cette étude, les chercheurs ont montré que le facteur XPC était également impliqué dans un mécanisme fondamental de l’expression des gènes, l’initiation de la transcription. Ces résultats sont publiés le 4 juillet 2018 dans la revue Nature Communications.
Le Xeroderma pigmentosum est une maladie génétique rare qui peut être liée à une mutation du gène codant pour la protéine XPC, un facteur de réparation de l’ADN qui reconnaît les lésions produites par les rayons ultraviolets. Les patients atteints de Xeroderma pigmentosum sont très sensibles au soleil et présentent un risque accru de cancer de la peau mais développent également d’autres troubles, neurologiques, oculaires ou de développement. Ces symptômes originellement associés à des défauts de la réparation pourraient aussi relever de perturbations de la transcription, mécanisme fondamental de l’expression des gènes. Les chercheurs de l’équipe dirigée par Frédéric Coin et Nicolas Le May ont donc cherché à établir le lien entre le facteur XPC et la transcription.
Ils ont tout d’abord utilisé des approches de génomique fonctionnelle qui leur ont permis d’observer la présence de la protéine XPC sur près de 500 promoteurs de gènes codant pour des protéines. Les sites d’occupation de la protéine XPC à l’ADN coïncident précisément avec ceux de l’ARN polymérase II, l’enzyme qui catalyse la transcription de ces gènes. En revanche, dans des cellules dérivées de patients dans lesquelles XPC est défectueux, ils ont montré que l’expression de ces gènes était dérégulée et que l’ARN polymérase II n’était plus recrutée correctement sur les promoteurs, mettant ainsi en évidence le lien entre le facteur XPC et la transcription.
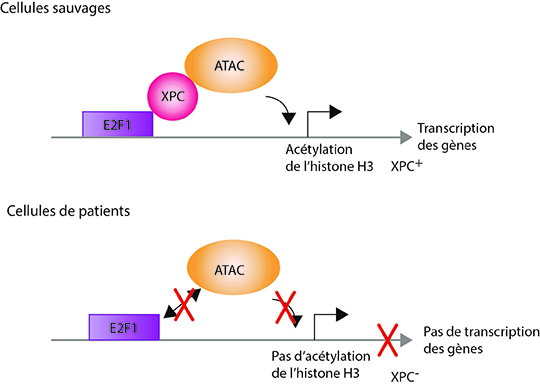
Les chercheurs ont ensuite analysé les modifications des histones qui sont essentielles à la mise en place d’un environnement chromatinien optimal à l’expression des gènes. Ils se sont en particulier intéressés à l’acétylation de l’histone H3, effectuée par deux complexes majeurs de la transcription, SAGA et ATAC. Ils ont observé que l’acétylation de l’histone H3 au niveau des 500 promoteurs de gènes nécessitait la présence de XPC. En effet, XPC interagit avec le complexe ATAC et permet le recrutement de ce dernier sur le promoteur des gènes.
Ils ont ensuite cherché à comprendre comment la protéine XPC, qui reconnaît normalement des lésions sur l’ADN, pouvait être recrutée sur des promoteurs. Ils ont montré que la protéine XPC interagissait avec la protéine E2F1, un facteur de transcription reconnaissant certaines séquences d’ADN présentes en amont des promoteurs de ces 500 gènes. Ainsi une succession d’événements, initiée par le recrutement du facteur de transcription E2F1 suivi de l’arrivée d’XPC et du recrutement d’ATAC conduit au remodelage de la chromatine et à l’expression de ces gènes.
Ces résultats montrent qu’en plus de son rôle dans la réparation de l’ADN, XPC régule la transcription ; ils permettent également de mieux comprendre les bases moléculaires des défauts des patients atteints de Xeroderma pigmentosum.
© IGBMC
En savoir plus
XPC is an RNA polymerase II cofactor recruiting ATAC to promoters by interacting with E2F1.
Bidon, B., Iltis, I., Semer, M., Nagy, Z., Larnicol, A., Cribier, A., Benkirane, M., Coin, F., Egly, JM., and Le May, N..
Nature Communications 9, 2018 July 4 doi: 10.1038/s41467-018-05010-0
