Des ARN messagers traduits aux pores nucléaires
Le fonctionnement des cellules repose sur le tri et l’acheminement des protéines néo-synthétisées vers les domaines sub-cellulaires où elles exercent leur action. En combinant des approches d’imagerie et de biochimie des ARN chez la levure, les scientifiques ont découvert que certains ARN messagers codant pour des protéines importées dans le noyau sont traduits au niveau des pores nucléaires. Cette étude est publiée dans la revue Molecular Cell.
L’identification des signaux qui permettent de distribuer les protéines dans les différents compartiments des cellules eucaryotes fait l’objet de recherches intensives depuis les années 1970. Les travaux du laboratoire de Günter Blobel (prix Nobel 1999) ont ainsi été les premiers à mettre en évidence l’existence de séquences signal dans les protéines naissantes, des « codes postaux » assurant leur traduction localisée à la surface du réticulum endoplasmique et leur ciblage vers la voie de sécrétion. Si de tels mécanismes d’adressage co-traductionnel se sont par la suite révélés applicables à d’autres compartiments cellulaires, une exception notable à ce dogme était jusqu’ici représentée par le noyau. Il était en effet admis que l’acheminement des protéines nucléaires s’effectue à la suite de leur synthèse dans le cytoplasme, via la reconnaissance de leurs séquences NLS (nuclear localization signal) par des récepteurs solubles, les karyophérines, qui assurent ensuite leur passage à travers des structures enchâssées dans l’enveloppe nucléaire, les complexes des pores nucléaires (NPCs).
En combinant l’identification systématique des ARNs associés à l’enveloppe nucléaire avec l’analyse de leur localisation in situ par microscopie, les scientifiques ont découvert que des messagers sont traduits en protéines au niveau des pores nucléaires chez la levure Saccharomyces cerevisiae. De manière frappante, ces ARNm codent principalement pour des protéines nucléaires, notamment des sous-unités de la face interne des pores, suggérant que certains polypeptides sont assemblés aux NPCs ou importés dans le noyau de manière co-traductionnelle.
Par quels mécanismes ces ARNm se localisent-ils spécifiquement au niveau des pores nucléaires ? Les chercheurs ont pu mettre en évidence que les protéines ainsi synthétisées exposent leurs séquences NLS à leur extrémité naissante, et que leur reconnaissance par les karyophérines est indispensable à la traduction localisée. En redirigeant artificiellement la synthèse de l’une de ces protéines à distance du noyau, ils ont pu observer des agrégats cytoplasmiques de cette dernière. La traduction localisée aux pores nucléaires permettrait donc d’éviter l’accumulation délétère de certaines protéines nucléaires dans le cytoplasme, un processus potentiellement critique pour des polypeptides toxiques ou susceptibles de s’agréger en dehors de leur compartiment de destination. Reste à comprendre à quel point la traduction localisée aux pores est une généralité chez les eucaryotes.
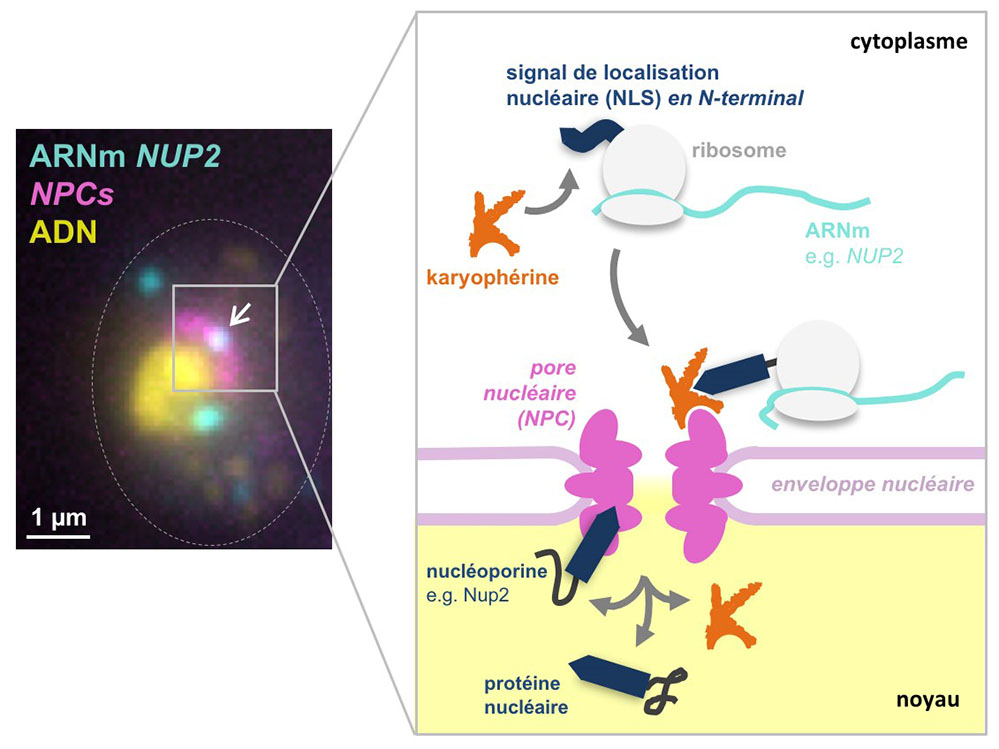
Figure : à gauche : image d’hybridation in situ révélant des molécules individuelles d’ARNm NUP2 (cyan), les pores nucléaires (magenta) et le noyau (jaune) dans des cellules de levure. A noter qu’un mutant de levure présentant une distribution asymétrique des NPCs a été utilisé afin de faciliter leur détection; à droite: représentation schématique du mécanisme d’adressage des ARNm aux NPCs
Pour en savoir plus
Co-translational assembly and localized translation of nucleoporins in nuclear pore complex biogenesis
Lautier O, Penzo A, Rouviere JO, Chevreux G, Collet L, Loiodice I, Taddei A, Devaux F, Collart MA & Palancade B
Molecular Cell.: April 9, 2021. DOI: 10.1016/j.molcel.2021.03.030
Contact
laboratoire
Institut Jacques Monod (CNRS/Université de Paris)
Bâtiment Buffon, 15 rue Hélène Brion
75205 Paris CEDEX 13 - France